- Myocardite, cardiomyopathie dilatée (CMD)/ Insuffisance cardiaque
- Virus-athérosclérose / Inflammation cardiovasculaire
- Virus-thrombose/ Inflammation cardiovasculaire
- Virus -Arrêts cardiaques (registre national & régional) / Mort subite cardiaque (MSC)
Projet scientifique
Contexte général
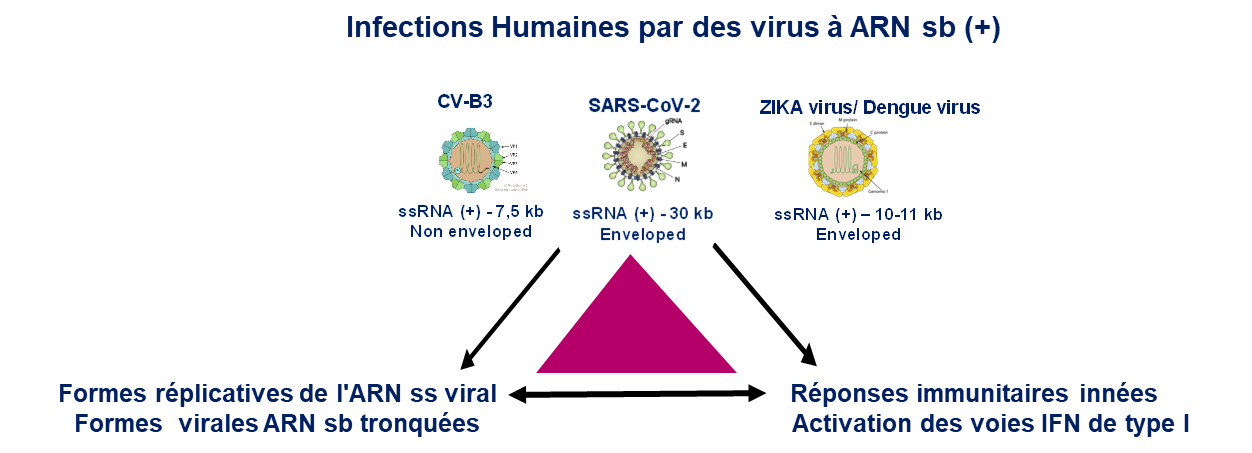
Les Entérovirus du groupe B (EV-B) (Picornaviridae) sont des virus non enveloppés à ARN simple brin de polarité positive. Ces agents pathogènes communs et ubiquitaires sont responsables d'infections communes de type aiguës ou persistantes dans différents tissus cibles humains dont le système cardiovasculaire. Leur génome ARN (+) de 7,5 kpb est composé à l'extrémité 5' d’une région non-codante qui est cruciale pour le déclenchement des mécanismes de réplication et de traduction virales.
Des formes virales naturelles présentant des délétions terminales de longueur variable en région 5' non-codante (5’NC) ont été caractérisée en utilisant des approches moléculaires (NGS) dans des infections murines ou humaines induites par EV-B par notre équipe.
L’équipe CardioVir étudie les mécanismes viraux et immunologiques impliqués dans les infections virales aiguës et persistantes cardiaques par les EV-B et leur rôle dans le développement de pathologie cardiaques inexpliquées.
Stratégie scientifique globale de CardioVir (UMR-S 1320) 2024-2029
Recherche translationnelle URCA-CHU: CardioVir UMR-S 1320
Thématiques de recherche : Equipe CardioVir (UMR-S 1320) 2024-2029
1/ Virus et mort subite cardiaque (MSC).
2/ Impact des infections virales dans le développement des cardiomyopathies (Myocardite, CMD).
3/ Etude la réponse inflammatoire et de la modulation de la réponse interféron de type I par les virus à tropisme cardiovasculaires (EV-B).
4/ Impact de l’Epitranscriptome du génome des virus à ARN+ (EV-B) sur l’infection des cellules cibles cardiovasculaires
Thématique 1 & 2
Impact des formes ARN tronquées du génome des entérovirus sur la réponse Interféron de type 1 au cours de la myocardite
Financement : Fédération française de cardiologie (FFC)
L’incidence de la myocardite est d’environ 1,5 millions de cas par an dans le monde. Aux USA et en Europe, cette cardiomyopathie résulte principalement d’une infection des tissus cardiaques par les entérovirus humains du groupe B, et elle est considérée comme une des causes majeures de mort subite cardiaque ou de cardiomyopathie dilatée (CMD) chez l’enfant et l’adulte jeune. Actuellement les mécanismes virologiques et immunologiques qui régulent la progression de la myocardite virale aiguë vers la forme sévère voir fulminante ou vers la phase chronique qui conduit à la CMD restent inconnus et limitent le développement de nouvelles stratégies thérapeutiques ciblées .
Nos investigations viro-cliniques (banques de prélèvements humains déjà constituées) et expérimentales (in vitro dans la cellule cardiaque humaine en culture et in vivo chez la souris DBA2/J) permettront: (I) d’identifier chez les Entérovirus du groupe B (CVB3) les séquences et structures ARN immunogènes de la région 5’NC capables d’activer la voie des interférons de type I chez l’homme; (II) de déterminer les principaux récepteurs de type RLR (RIG-1, MDA5, LGP2) dans les cellules cardiaques humaines capables de fixer les structures ARN virales identifiées précédemment (objectif I); (III) d’étudier la modulation des voies d’IFN de type 1 par des agonistes spécifiques des récepteurs de l’immunité innée (identifiés au cours de l’objectif II) et l’impact de cette activation sur les scores de lésions cardiaques et la mortalité des souris DBA2/J présentant une myocardite aigue ou chronique à virus CVB3/28.
Les résultats immmuno-virologiques obtenus au cours de l’étude de la phase aigue de la myocardite à entérovirus permettront d’identifier de nouveaux biomarqueurs virologiques ou immunologiques qui autoriseront en pratique clinique la détection des patients à « risques de formes cliniques sévères ou chroniques ». De plus nos données expérimentales obtenues dans le modèle murin de myocardite à CVB3 pourraient permettre à terme de proposer de nouveaux traitements de type immuno-modulateur (immunothérapies) adaptés au stade d’évolution et de la sévérité clinique de la myocardite virale.
Mots clés : myocardite, réponse immunitaire innée, Enterovirus, Interféron de type 1, 5’NC.
Thématique 3
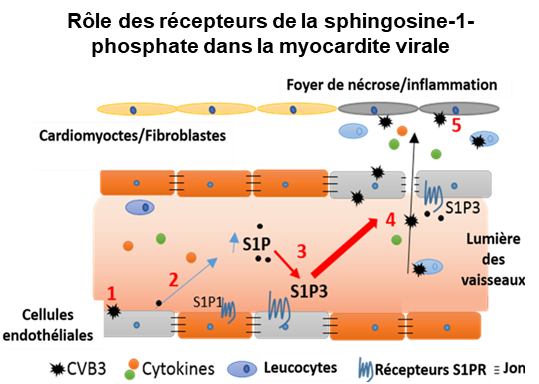
Rôle de la sphingosine-1 phosphate et ses récepteurs dans la myocardite induite par les Entérovirus du groupe B
Pour infecter les cardiomyocytes, le virus cardiotrope doit franchir l'endothélium vasculaire qui représente ainsi une première ligne de défense antivirale. Les cellules endothéliales sont identifiées comme étant le chef d’orchestre de la réponse inflammatoire au cours d’une infection virale. Ainsi, la modulation de réponse inflammatoire excessive au niveau de l’endothélium vasculaire induite par CVB3 au cours de la myocardite aiguë pourrait permettre de prévenir le développement des formes fulminantes mais aussi la progression vers la CMD.
Les modulateurs chimiques des récepteurs cellulaires de la famille de la Sphingosine-1 Phosphate, S1PR1-S1PR5, jouent des rôles clefs dans la réponse immunitaire au cours de pathologies telles que la sclérose en plaques ou la grippe. L’activation de voies de signalisation par la S1P exerce des actions cardioprotectrices et immunomodulatrices puissantes régulant le tonus vasculaire et la barrière endothéliale10. À un faible niveau de concentration, la S1P est connue pour améliorer l'intégrité de la barrière endothéliale via S1P1R et à niveaux élevés de perturber la barrière endothéliale via le S1P3R. Des études expérimentales ont montré que la concentration de la S1P dans le sang régule l’inflammation. Ce concept est bien documenté dans plusieurs pathologies. Des études expérimentales ont montré que l'activation pharmacologique des récepteurs S1P (S1PR) par un agoniste était associée à un effet protecteur dans un modèle murin de myocardite induite par le virus murin ECMV.
Cependant, les conséquences de l'infection par le CVB3 sur la sécrétion de S1P et l’activation des récepteurs S1P restent à ce jour inconnues chez l’homme et donc à explorer.
Thématique 4
Impact de l’épitranscriptome des ARN viraux au cours de l’infection (ViroMOD)
Financement : Fonds régional de coopération pour la recherche-APP 2021-2023, PI : Yuri Motorin (Université de Lorraine) ; Co-PI: Carine Meignin (Université de Strasbourg) et Laurent Andreoletti (66,6K euros de fonds Feder).
Collaborations:
- IMoPA (Ingénierie Moléculaire et Physiopathologie Articulaire) - UMR 7365 CNRS – Université de Lorraine
- M3i Modèles insectes d’immunité innée – UPR 9022 – Université de Strasbourg
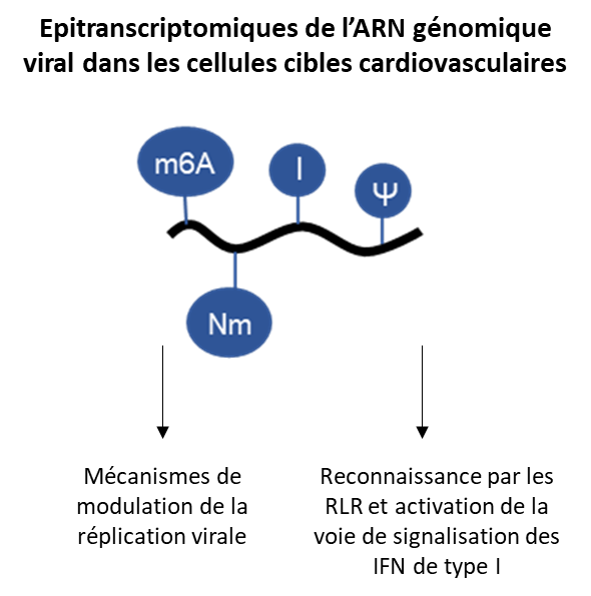
Les modifications de l'ARN, appelées communément épitranscriptome, sont observées sur des résidus spécifiques des ARN cellulaires et jouent un rôle clé pour leur maturation et leur fonctionnalité. Parmi plus de cent cinquante modifications chimiques décrites, la méthylation des nucléotides en différentes positions est la plus abondante. Au cours de la dernière décennie, le développement de nouvelles approches de détection par séquençage à haut débit à l’échelle du génome a conduit à l’identification de la méthylation des ARNm apportant un nouveau niveau de régulation de l’expression des gènes.
Cependant, très peu d'études ont été consacrées jusque-là aux modifications des ARN viraux et, malgré l'identification de certaines modifications de l'ARN présentes dans les virus, peu des choses sont connues pour leurs rôles dans l'infection et la propagation des virus. Certaines modifications des ARN viraux apparaissent aujourd’hui fondamentales pour la régulation des arbovirus (ZIKA et Dengue) et d’autres virus. Ce projet ambitieux comporte une dimension intégrative, puisqu’il associe la cartographie de l’épitranscriptome des ARN viraux à des approches de génétique et de virologie moléculaire.
Le projet ViroMOD rassemble des partenaires en Lorraine, Alsace et Champagne-Ardenne qui sont des scientifiques avec une visibilité internationale et d’horizons divers incluant des biologistes de l’ARN (IMoPA, Nancy), experts en virologie moléculaire et génétique des insectes (UPR9022, Strasbourg) et en virologie médicale (EA-4684, Reims). Le projet ViroMOD générera des synergies fortes entre des expertises complémentaires en intégrant différentes approches technologiques et modèles biologiques.
Le projet a trois objectifs scientifiques, cartographier des modifications post-transcriptionnelles des ARN génomiques (ARNg) de polarité positives pour les virus CVB3 et SARS-Cov-2 ; étudier l’impact des modifications des ARNg sur la biogenèse et maturation du génome viral et la détection de l’ARN viral modifié par le système immunitaire inné de l'hôte.
Dans le domaine de la virologie moléculaire, la caractérisation exhaustive de l’épitranscriptome des ARN viraux sera cruciale pour une meilleure compréhension des mécanismes de défense contre ces infections. La modulation des modifications de l’ARN viral peut aider à rétablir l’efficacité des mécanismes de reconnaissance ainsi que l’élimination du virus, ou, au moins, limiter très largement sa propagation.
Mots clés: Infection, virologie moléculaire, épitranscriptomique, modification des ARN