2. Réactions multicomposantes et catalyse asymétrique organique.
(Dr. Fabienne Grellepois, Dr. Emmanuel Riguet)
(Dr. Fabienne Grellepois, Dr. Emmanuel Riguet)
1. Sélection de publications récentes
a-Trifluoromethylated tertiary homoallylic amines : Diastereoselective synthesis and conversion into b-aminoesters, g- and d-aminoalcohols, azetidines and pyrrolidines.
Grellepois, F. ; Ben Jamaa, A. and Saraiva Rosa, N. Org. Biomol. Chem. 2017, 15, 9696-9709.
Iridium-catalysed asymmetric allylic alkylation of benzofuran g-lactones followed by heteroaromatic Cope rearrangement: study of an unusual reaction sequence.
Bos, M., and Riguet, E. Chem. Commun. 2017, 53, 4997-5000.
Diastereoselective Ritter-like reaction on cyclic trifluoromethylated N,O-acetals derived from L-tartaric acid.
Ben Jamaa, A. and Grellepois, F. J. Org. Chem. 2017, 82, 10360-10375.
Synthesis of chiral γ-lactones by one-pot sequential enantioselective organocatalytic Michael addition of boronic acid and diastereoselective intramolecular Passerini reaction.
Bos, M. and Riguet, E. J. Org. Chem. 2014, 79, 10881-10889 (Souligné dans Org. Proc. Res. Dev. par la rédaction)
Diastereoselective addition of organomagnesium and organolithium reagents to chiral trifluoromethyl N-tert-butanesulfinyl hemiaminals.
Grellepois, F. ; Ben Jamaa, A. and Gassama, A. Eur. J. Org. Chem. 2013, 6694-6701.
Enantiopure trifluoromethylated b3,3-amino acids : Synthesis by asymmetric Reformatsky reaction with stable analogues of trifluoromethyl N-tert-butanesulfinyl ketoimines and incorporation into a/b-peptides.
Grellepois, F. J. Org. Chem. 2013, 78, 1127-1137.
Enantioselective organocatalytic friedel-crafts alkylation reaction of indoles with 5-hydroxyfuran-2(5 H)-one: Access to chiral g-lactones and g-lactams via a Ugi 4-center 3-component réaction.
Riguet, E. J. Org. Chem. 2011, 76, 8143-8150 (Featured Article, highlighted on cover of the issue 20, 21st October 2011).
2. Réactions multicomposantes et catalyse asymétrique organique.
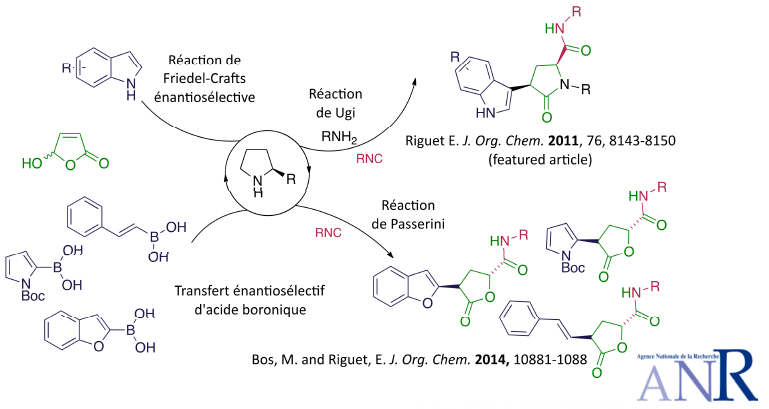
Les réactions multicomposantes sont des outils privilégiés pour générer une grande diversité structurale en très peu d’étapes et avec une grande économie d’atomes. Cependant l’accès à des molécules chirales par ce type de stratégie est souvent limité aux réactifs issus du pool chiral. Nous avons initié un programme de recherche dont l’objectif général est de combiner une étape de catalyse énantiosélective conduisant à un intermédiaire chiral hautement fonctionnalisé pouvant être directement engagé dans une réaction multicomposante. La synthèse de lactames et lactones chiraux hautement fonctionnalisés a ainsi pu être effectuée. Une partie de ces travaux a été réalisée avec le soutien de l’ANR (ANR JCJC HFOrgCat octobre 2012-mars 2016).

3. Réactions d’alkylations allyliques et réactions sigmatropiques
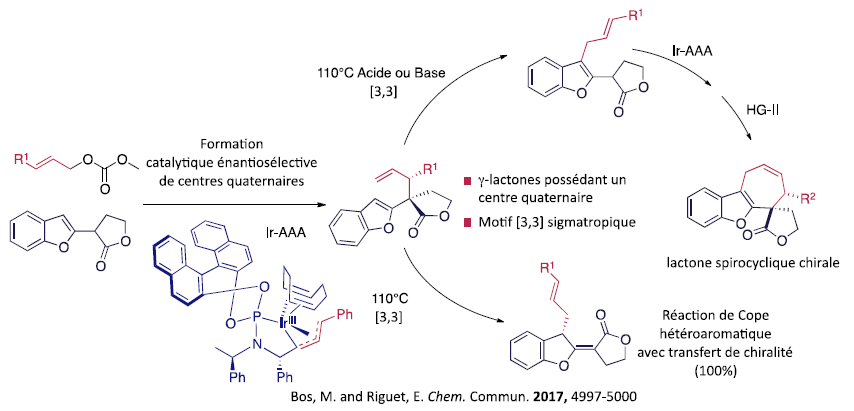
Nous nous sommes récemment intéressés à l’utilisation de lactones substituées en position α et de leurs énolates prochiraux correspondants dans les réactions d’alkylations allyliques asymétriques (AAA). Une première approche utilisant des réactions d’alkylations allyliques catalysées par des complexes de l’iridium nous a permis d’accéder à des lactones chirales possédant un centre quaternaire et un centre tertiaire adjacents. L’utilisation de lactones substituées par un hétérocycle nous a permis d’explorer la réactivité de ce type de dérivés vis-à-vis du réarrangement sigmatropique [3,3]. Nous avons notamment exploité cette réactivité pour accéder à des lactones chirales spirocycliques.
4. Synthèse diastéréosélective de composés azotés trifluorométhylés.
Ce projet concerne la réaction de N,O-acétals a-trifluorométhylés avec des nucléophiles variés afin d’accéder en peu d’étapes à de petites molécules énantiopures possédant un groupement trifluorométhyle porté par un carbone quaternaire adjacent à une fonction amine.
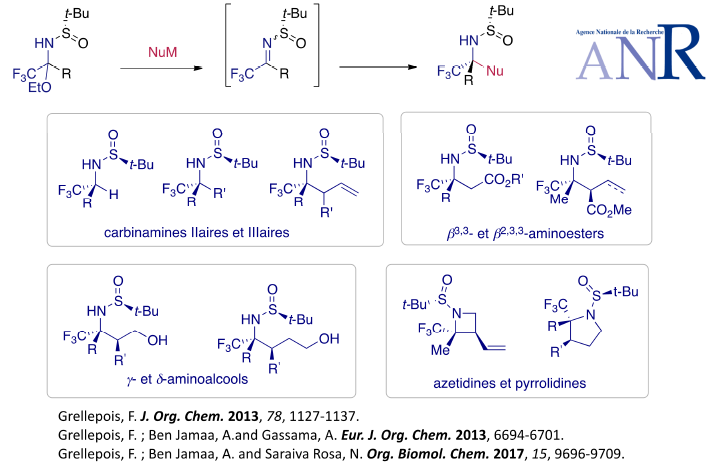
L’addition diasteréosélective de dérivés organométalliques sur des intermédiaires de type imine N-substitués par l’auxiliaire d’Ellman a permis d’accéder, par exemple, à des acides b-aminés et des carbinamines tertiaires énantiopures avec de très bons excès diastéréomérqiues. Une partie de ces travaux a été réalisée avec le soutien de l’ANR (ANR JCJC TFM4Asym mars 2014- février 2018).
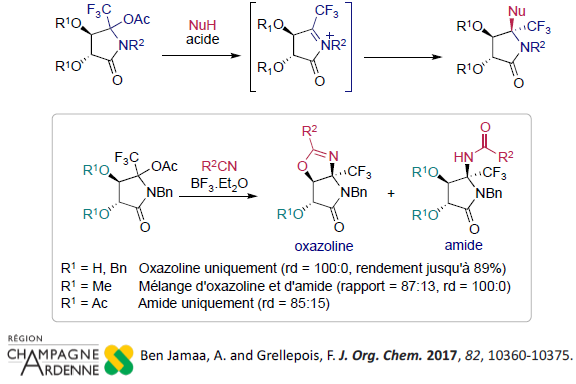
L’addition diasteréosélective de nucleophiles, par exemple des nitriles, sur des intermédiaires N-acyliminium a-trifluorométhylés dérivés de l’acide (L)-tartrique, un co-produit de l’industrie vinicole, nous a permis d’accéder à des dérivés de pyrrolidones originaux. Ce projet a été soutenu par un financement de la région Champagne-Ardenne (projet essaimage FLUOSYNTH décembre 2012-décembre 2016).