- Transdifférenciation dans la CF et la BPCO
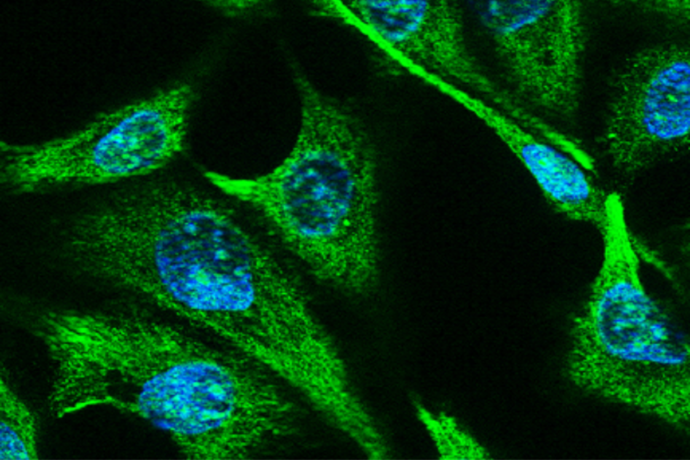
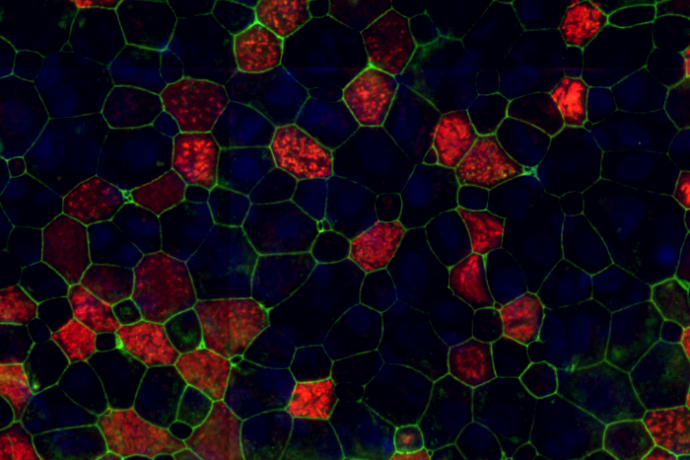
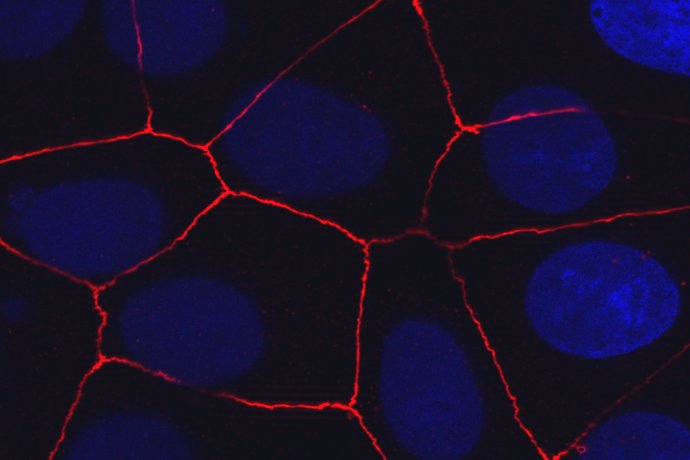
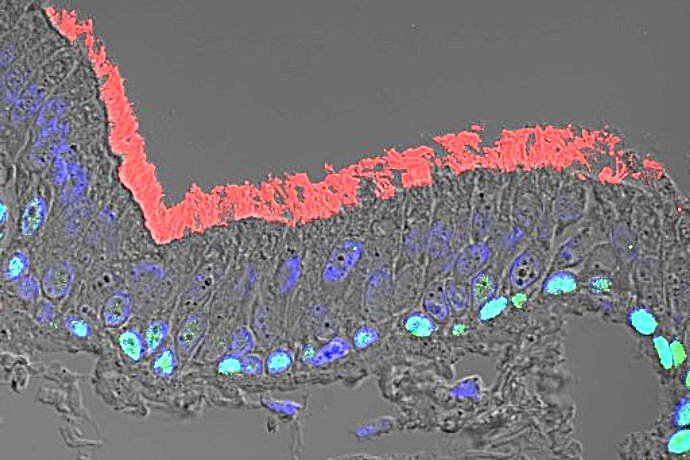
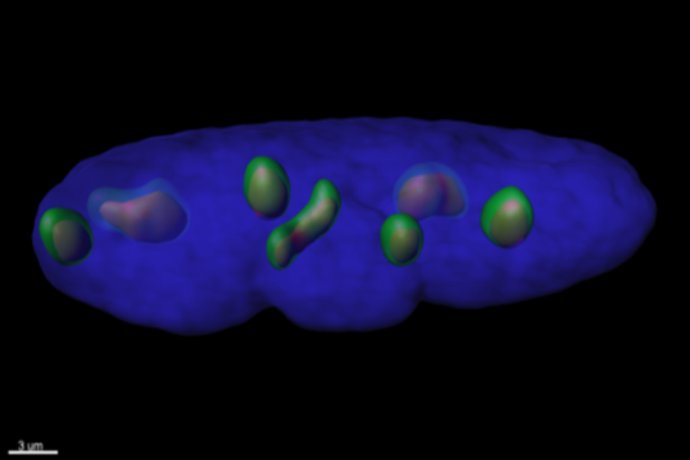
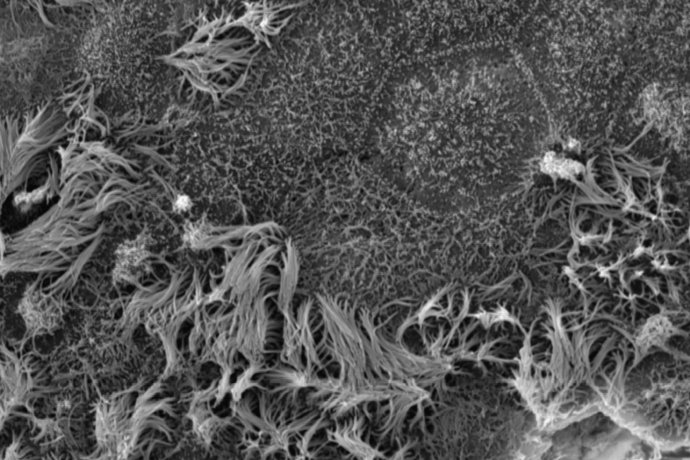
Pour étudier les mécanismes de régénération et de remodelage de l’épithélium respiratoire, nous utilisons des cellules respiratoires primaires dissociées à partir de pièces chirurgicales endo-nasales ou pulmonaires humaines issues de sujets contrôles ou de patients souffrant de BPCO et de CF. Des études histologiques et immunohistochimiques de ces cellules sont réalisées in vivo, au sein du tissu d’origine et dans un modèle murin de xénogreffe, et in vitro dans divers modèles de cultures tridimensionnelles afin d’analyser l’expression de marqueurs de transdifférenciation cellulaire. Ces modèles in vitro de culture des cellules respiratoires en interface air-liquide, sous forme de sphères en milieu liquide ou dans un gel permettent de récapituler les différentes étapes de la régénération aboutissant à la reconstitution d’un épithélium mature et fonctionnel, mais également d’étudier le développement d’un remodelage tissulaire. Les facteurs impliqués dans ces phénomènes ainsi que leur impact sur la fonctionnalité épithéliale, en termes de défense et de clairance mucociliaire, peuvent ainsi être analysés à l’échelle cellulaire et moléculaire. Par ailleurs, ces approches de reconstitution épithéliale nous permettent de tester le potentiel de composés pharmacologiques à visée thérapeutique.
- Dédifférenciation et cancers des voies aériennes
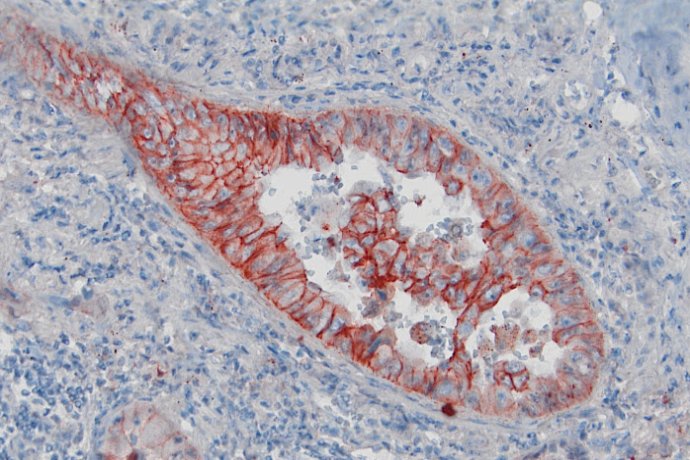
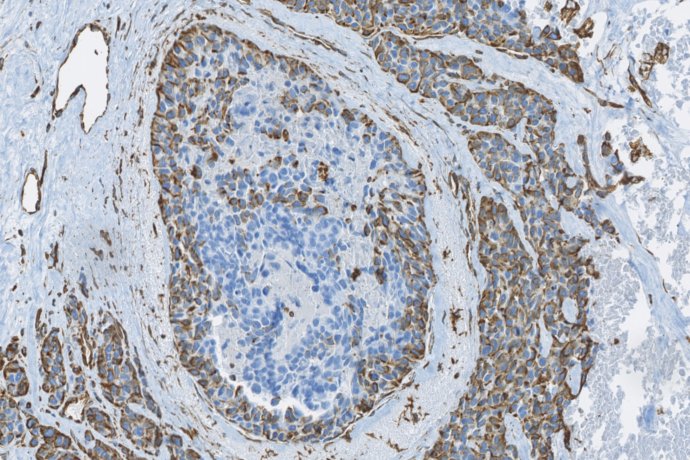
L’étude de la dédifférenciation au cours de la progression tumorale est abordée par des approches in vivo et in vitro. Des analyses histologiques et immunohistochimiques sont réalisées sur des prélèvements humains issus de la banque de tumeurs du pôle de Biologie Médicale et Pathologie du CHU de Reims et de la Tumorothèque de Champagne-Ardenne. Nous réalisons également par des méthodologies de biologie moléculaire et cellulaire intégrée des études fonctionnelles à partir de cultures primaires et de lignées cellulaires tumorales. Les cellules tumorales cultivées sont testées dans des modèles in vitro d’invasion en chambre de Boyden, de migration 3D en gel de collagène (cellules dispersées ou sphéroïdes) couplés à des systèmes d’analyse d’image développés par nos soins. Cet axe recourt également à des modèles in vivo murins reproduisant les étapes précoces et tardives de la progression métastatique. Ces approches permettent de mettre en évidence de nouveaux marqueurs pronostiques et d’identifier de nouvelles pistes thérapeutiques anti-cancéreuses.
Si les mécanismes observés dans ces différentes pathologies sont parfois différents, de nombreuses molécules et de nombreux processus physiopathologiques communs sont impliqués dans la plasticité des cellules épithéliales et font l’objet de travaux transversaux entre les deux thématiques de l’Unité. L’ensemble des travaux réalisés a permis de mettre en évidence que plusieurs facteurs pouvaient être considérés comme des biomarqueurs attestant du remodelage des voies aériennes. Nos données ont également démontré que ces facteurs sont impliqués fonctionnellement dans la mise en place de la plasticité cellulaire dont font preuve les cellules épithéliales dans les différentes pathologies pulmonaires étudiées, permettant ainsi d’envisager qu’elles puissent être de futures cibles thérapeutiques.