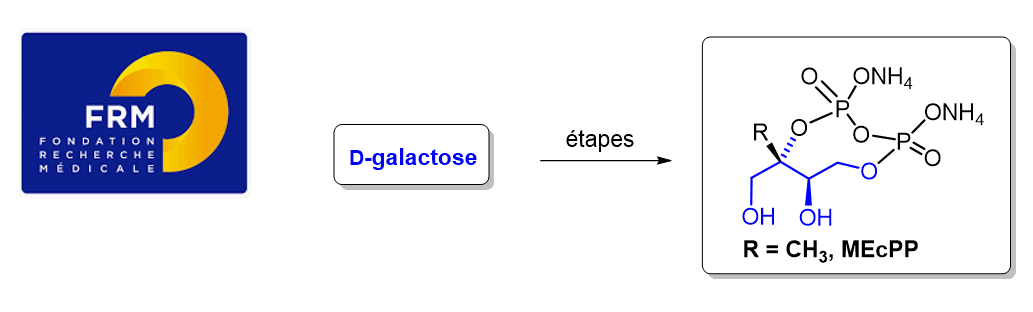
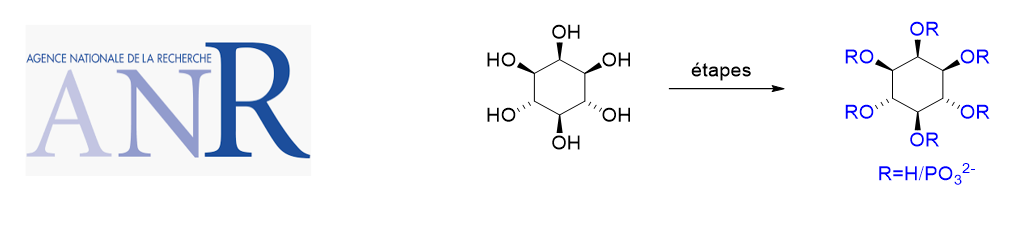
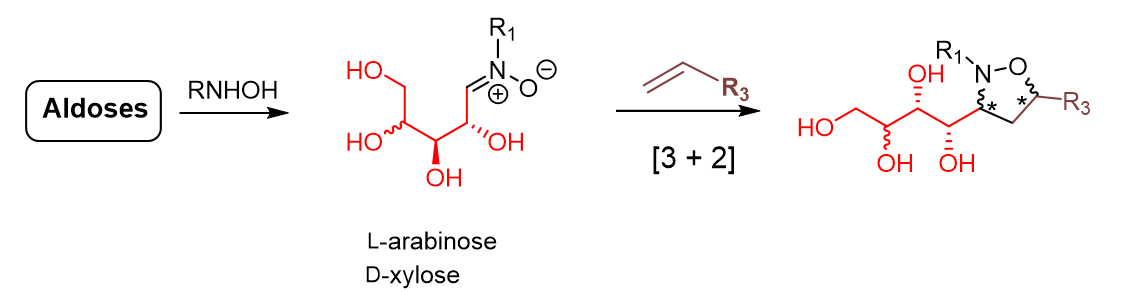
Aza-Henry reaction with nitrones, an under-explored transformation, Messire, G.; Massicot, F.; Vasse, J.-L., Behr, J.-B., Eur. J. Org. Chem. 2019, 1659-1668.
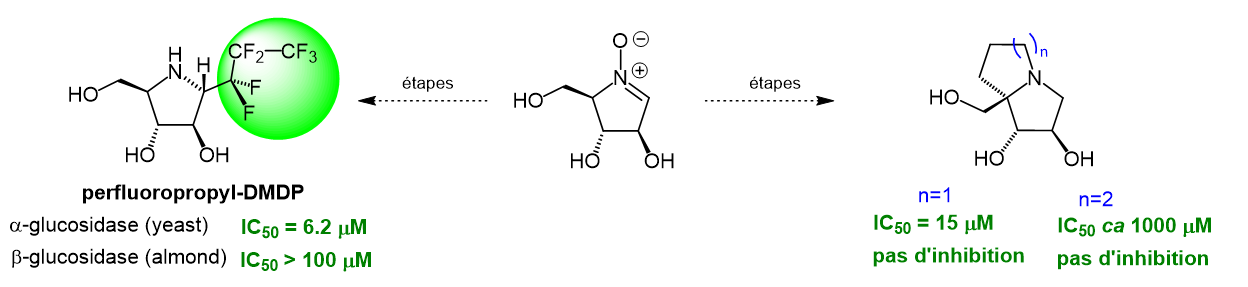
Synthesis and glycosidase inhibition potency of all-trans substituted 1-C-perfluoroalkyl iminosugars, Massicot, F.; Plantier-Royon, R.; Vasse, J.-L.; Behr, J.-B., Carbohydr. Res. 2018, 464, 2-7.
Short synthesis, X-ray and conformational analysis of a cyclic peracetylated l-sorbose-derived nitrone, a useful intermediate towards N-O-containing D-gluco-iminosugars, Tangara, S.; Kanazawa, A.; Fayolle, M.; Philouze, C.; Poisson, J.-F.; Behr, J.-B.; Py, Sandrine, New J. Chem., 2018, 42, 16735-16743.
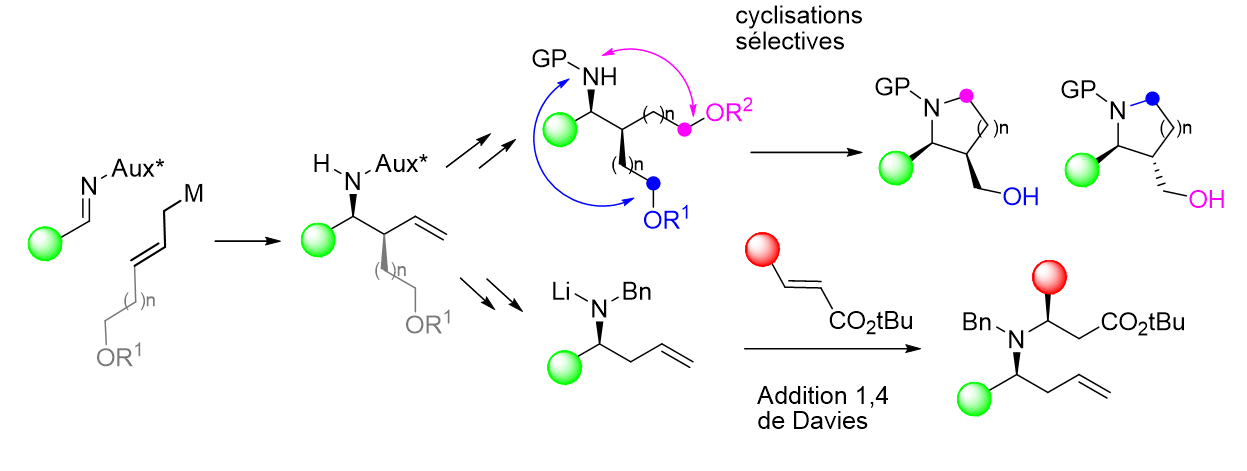
Ring-Junction-Substituted Polyhydroxylated Pyrrolizidines and Indolizidines from Ketonitrone Cycloadditions, Lieou Kui, E.; Kanazawa, A.; Behr, J.-B.; Py, S., Eur. J. Org. Chem., 2018, 2178-2192.
Application of elemental lanthanides in the selective C-F activation of trifluoromethylated benzofulvenes providing access to various difluoroalkenes, Kumar, T.; Jaroschik, F.; Ben Hassine, A.; Martinez, A.; Harakat, D.; Chevreux, S.; Massicot, F.; Behr, J.-B.; Vasse, J.-L.; Taillefer, M. JoVE (J. of visualized Exp.) 2018, 137.
Single or synergistic kinetic resolutions of chiral allylalanes: two complementary routes for the asymmetric synthesis of syn homoallylamines, Coffinet, M.; Behr, J.-B.; Jaroschik, F.; Harakat, D.; Vasse, J.-L., Org. Lett., 2017, 19, 6728-6731.
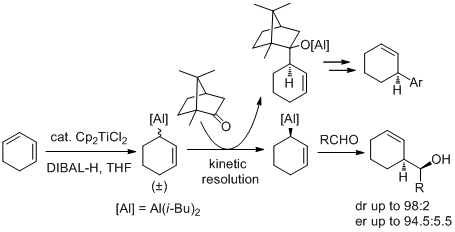
(+)-Camphor-mediated kinetic resolution of allylalanes: a strategy towards enantio-enriched cyclohex-2-en-1-ylalane, Coffinet, M.; Massicot, F.; Joseph, J.; Behr, J.-B.; Jaroschik, F.; Vasse, J.-L., Chem. Commun. 2017, 53, 111-114.
Polyhydroxylated quinolizidine iminosugars as nanomolar selective inhibitors of α-glucosidases, Vieira Da Cruz, A.; Kanazawa, A.; Poisson, J.-F.; Behr, J.-B.; Py, S. J. Org. Chem., 2017, 9866–9872.
Generation of ε,ε-difluorinated metal-pentadienyl species through lanthanide-mediated C-F activation, Kumar, T.; Massicot, F.; Harakat, D.; Chevreux, S.; Martinez, A.; Bordolinska, K.; Preethalayam, P.; Kokkuvayil Vasu, R.; Behr, J.-B.; Vasse, J.-L.;. Jaroschik, F. Chem. Eur. J. 2017, 23,16460-16465.
Synthesis, Characterization and Reactivity of Formal 20 Electron Zirconocene-Pentafulvene Complexes, Jaroschik, F.; Penkhues, M.; Bahlmann, B.; Nicolas, E.; Fischer, M.; Massicot, F.; Martinez, A.; Harakat, D.; Schmidtmann, M.; Kokkuvayil Vasu, R.; Vasse, J.-L.; Beckhaus, R. Organometallics, 2017, 36, 2004-2013.
Tetramethylammonium Fluoride, Massicot, F.; Behr, J.-B. e-EROS Encyclopedia of Reagents for Organic Synthesis, 2017.
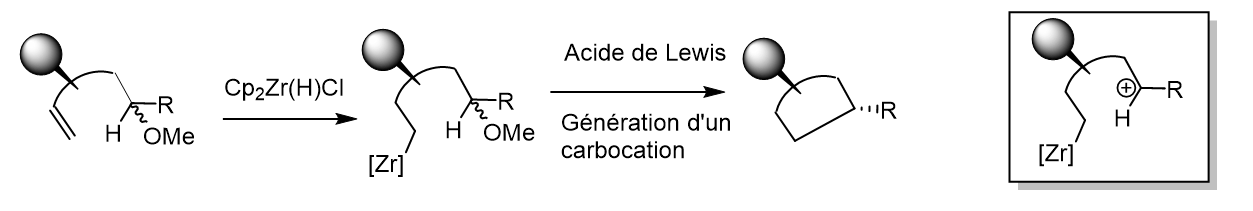
Zirconocenes vs. Alanes, a Crucial Choice of the Allyl Source for a Highly Diastereoselective Allylzincation of Non-racemic Chiral Imines, Coffinet, M.; Jaroschik, F.; Vasse, J.-L., Eur. J. Org. Chem. 2016, 2319-2326.
Cyclopent-2-enylaluminium as allylzinc precursor for the diastereoselective allylmetallation of non-racemic imines: applications to the synthesis of enantiomerically enriched heterocycles, Coffinet, M.; Lamy, S.; Jaroschik, F.; Vasse, J.-L., Org. Biomol. Chem. 2016, 14, 69-73.
Exploring the divalent effect in fucosidase inhibition with stereoisomeric pyrrolidine dimers, Hottin, A.; Wright, D.; Moreno-Clavijo, E.; Moreno-Vargas, A. J.; Davies, G. J.; Behr, J.-B. Org. Biomol. Chem. 2016, 14, 4718-4727.
Determination of the relative configuration and conformational analysis of five–membered N-Acyl-iminosugars by relevant 3J coupling constants, LeNouen, D.; Behr, J.-B.; Defoin, A. Chem. Select 2016, 1, 1256-1267.
Expanding the library of divalent fucosidase inhibitors with polyamino and triazole-benzyl bridged bispyrrolidines, Hottin, A.; Carrion-Jimenez, S.; Moreno-Clavijo, E.; Moreno-Vargas, A. J.; Carmona, A. T.; Robina, I.; Behr, J.-B. Org. Biomol. Chem. 2016, 14, 3212-3220
A second-generation ferrocene-iminosugar hybrid with improved fucosidase binding properties, Hottin, A.; Scandolera, A.; Duca, L.; Wright, D. W.; Davies, G. J.; Behr, J.-B. Bioorg. Med. Chem. Lett. 2016, 26, 1546-1549.