Activités du Groupe
Thématiques de recherche
La recherche dans le domaine de la RMN développée dans le groupe Isolement et Structure s’appuie sur la disponibilité d’un spectromètre à 500 MHz équipé de sondes pour les liquides (BBFO+), pour les échantillons inhomogènes (HR-MAS, 4 mm), pour les solides (13C, 4 mm) et pour la micro-imagerie (1H) et d’un spectromètre à 600 MHz équipé d’une cryo-sonde.et d’un système LC-SPE-RMN.
Les travaux de recherche récents concernent :
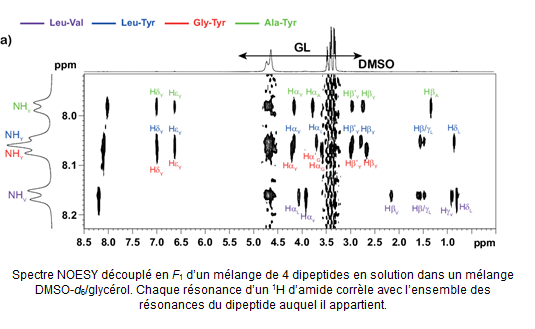
- L’analyse de mélanges en milieu ultra-visqueux où les différentes résonances de chaque composé sont corrélées entre elles par diffusion de spin, de manière à pouvoir extraire les spectres individuels des composantes du mélange (P. Lameiras et al., Anal. Chem. 2016, doi : 10.1021/acs.analchem.6b00481).
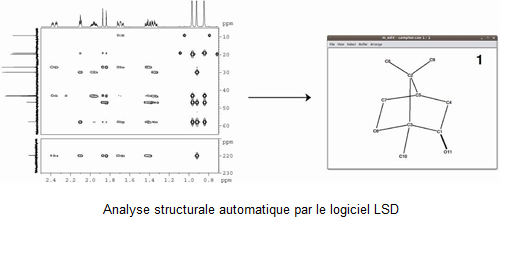
- L’exploitation automatique des données de la RMN 2D par le logiciel LSD (www.univ-reims.fr/LSD) fait l’objet d’améliorations successives destinées à en en élargir les possibilités et à diminuer la part d’intervention de l’utilisateur. Le logiciel LSD utilise les spectres 2D HSQC, COSY et HMBC pour proposer une ou plusieurs structures compatibles avec les données expérimentales et celles fournies par l'utilisateur. Il s'applique à l'étude des petites molécules organiques en solution (B. Plainchont et al., Magn. Reson. Chem. 2013, doi : 10.1002/mrc.3965).
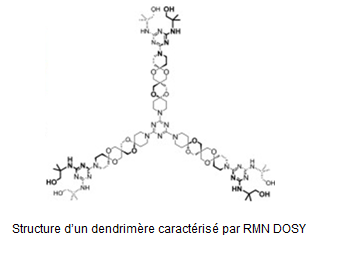
- La caractérisation d’objets macromoléculaires (dendrimères, O. Moldovan et al. Tetrahedron 2013, doi : 10.1016/j.tet.2012.12.059) ou supramoléculaires (micelles) et la compréhension de mécanismes d’interaction en CPC au moyen de mesures de coefficients de diffusion translationnelle (DOSY) en collaboration avec l’Université de Cluj-Napoca (Roumanie).
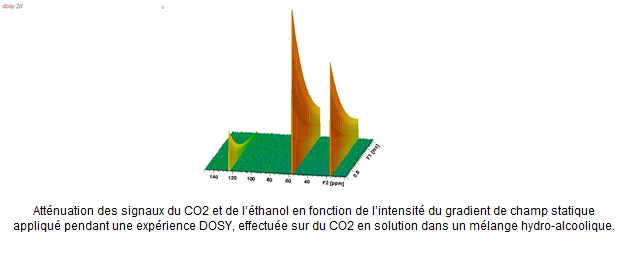
- La mesure du coefficient de diffusion du CO2 et de l’éthanol dans des solutions hydro-alcooliques modèles mimant un vin effervescent de Champagne. Les résultats obtenus sont en accord avec des simulations numériques (D. Bonhommeau et al., J. Phys. Chem. Lett. 2014, doi : 10.1021/jz502025e) effectuées au GSMA (UMR CNRS 7331, Reims).
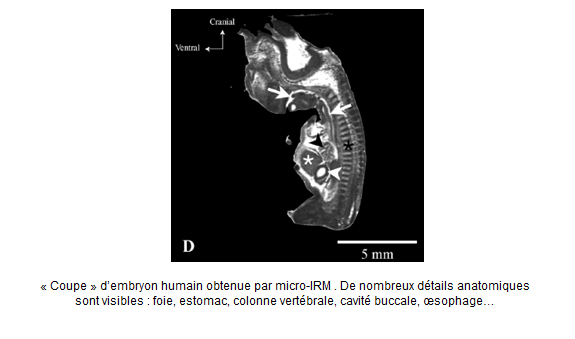
- l’étude par RMN 3D d’embryons humains et de souris. Les images obtenues sont de bonne qualité et présentent un intérêt certain en embryologie descriptive ; elles ont été enregistrée avec la collaboration du laboratoire d’anatomie de l’université de Reims (M. Luhaire et al., Ann. Anat. 2014, 10.1016/j.aanat.2014.07.004).
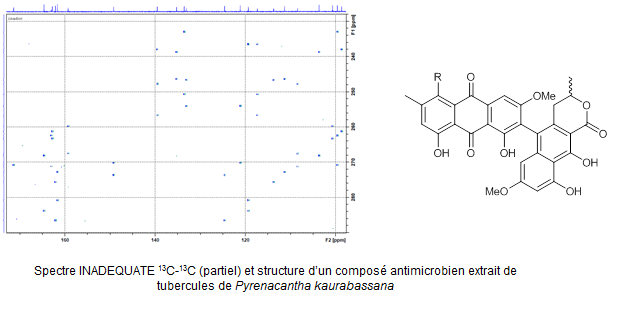
- l’utilisation de la séquence RMN INADEQUATE et des moyens de l’iR- RMN du CNRS pour la révision de la structure d’une substance naturelle à propriétés anti-microbiennes et dont la structure comporte une proportion importante de d’atomes de carbone quaternaires (L. Boudesocque et al., J. Nat Prod. 2015, doi : 10.1021/np5003252).
La Chromatographie de Partage Centrifuge est une technique de chromatographie liquide-liquide basée sur le partage des solutés entre deux phases liquides non miscibles préparées par mélange de 2, 3 ou plus solvants et/ou solutions. Une phase est maintenue stationnaire dans la colonne (le rotor) par un champ de force centrifuge constant, l’autre – la phase mobile - étant pompée au travers.
Visualisation du passage en mode ascendant de la phase mobile
merci aux Drs A. Foucault et L. Marchal, UMR 6144
La CPC est étudiée à Reims depuis une quinzaine d’années, que ce soit au niveau méthodologique ou de ses applications pour l’isolement de molécules naturelles ou synthétiques. L’équipe dispose de plusieurs type d’appareils :
- Chromatographes de Partage Centrifuge et Extracteur de Partage Centrifuge de marque Rousselet-Robatel-Kromaton (http://www.kromaton.com/)
- Chromatographe de Partage Centrifuge de marque Armen Instrument (http://www.armen-instrument.com/)
Chaîne de Chromatographie de Partage Centrifuge
Trois axes de recherche, fortement interconnectés, fédèrent l’ensemble des sujets développés :
1 - Méthodologie et mode de développement par déplacement
2 - Application à l’isolement de Substances Actives et industrialisation de procédé
3 - Obtention et analyse de mélanges de Naturelles bioactive
PRINCIPAUX PROGRAMMES COLLABORATIFS :
- Projet ANR CD2I « xPC » (coll. UMR CNRS 6144, UMR CNRS 5503, Laboratoires Pierre Fabre, Rousselet-Robatel Kromaton)
- Projet européen FP7 Marie Curie IAPP « NATPROTEC » (Coll. Université d’Athènes, Université de Genève, Université D’Innsbruck, Korres, Rousselet-Robatel Kromaton, Camag, Bionorica).
VALORISATION :
- Principales collaborations industrielle
AXES DE RECHERCHE
1 - Méthodologie et mode de développement par déplacement
Cet axe, essentiellement méthodologique, vise à développer de nouveaux outils en Chromatographie de Partage Centrifuge (CPC), naturellement en lien étroit avec les préoccupations de la thématique « Substances Naturelles Complexes» (peptides, saponines,…) mais également avec des problématiques étudiées au travers de collaborations industrielles ou institutionnelles. Une part importante de ces travaux porte sur l’étude et l’implantation industrielle du mode déplacement (http://eos.univ-reims.fr/LSD//JmnSoft/CpcSim/index.html) appliqué à la CPC, et plus particulièrement sur le mode échange d’ions fort (SIXCPC) introduit par notre équipe.
Modélisation de la séquence injection/développement en mode échange d’ion
L’étude des interactions « analyte-échangeur » est réalisée en lien étroit avec l’équipe « Méthodes d’analyse avancées par RMN » et avec la Plateforme de Modélisation Moléculaire (https://romeo.univ-reims.fr/), tandis que la conception des échangeurs ioniques quant à elle réalisée en interaction avec le groupe BSMA.
Un autre aspect de nos travaux concerne l’étude de paramètres inhérents à la CPC tels que la compréhension des perturbations hydrodynamiques occasionnées par la mise hors équilibre du système biphasique principalement lors de l’injection, aspect qui constitue le principal verrou scientifique pour le développement industriel de la technique (coll. Drs L. Marchal et A. Foucault, UMR 6144 (http://www.gepea.fr/, Saint-Nazaire).
2 - Application de la CPC à l’isolement de Substances Actives et industrialisation de procédés
Cet aspect constitue d’une part en un prolongement logique des thèmes de recherche cités ci-dessus et d’autre part le point d’ancrage le plus évident de la thématique CPC au thème fédérateur de notre groupe de Recherche : les Substances Naturelles. Plusieurs classes de composés naturels ou issus de la synthèse organique ont été étudiées, principalement dans le cadre de collaborations académiques ou industrielles : anthocyanosides, alcaloïdes, galactosylglycerides, stilbénoïdes, chalcones, glucosinolates, lignines, peptides, nucléotides&helli
Ces travaux nous conduisent, dans le cadre d’interactions industrielles, à étudier l’industrialisation des procédés développés en intégrant des contraintes liées à la rentabilité du procédé ou aux aspects environnementaux. Dans ce cadre, des solutions originales ont été introduites, telles que le développement de nouveaux systèmes biphasiques de solvants, l’utilisation du mode co-courant ou l’introduction du mode semi-continu « multiples dual-modes ».

Chaîne pilote de Chromatographie de Partage Centrifuge FCPC Kromaton,
capacité de la colonne : 5 L, injection 50-500 g
L’utilisation de la CPC en mode séquentiel (Multiple Dual-Modes) est un autre mode particulièrement adapté à une utilisation routinière dans le domaine de la synthèse organique.
3 - Obtention et analyse de mélanges de Substances Naturelles bioactives
Cette approche originale consiste à développer de nouvelles combinaisons de protocoles d’extraction et d’analyse permettant d’appréhender les mélanges de substances naturelles non pas sous la forme de composés individuels purifiés mais sous forme d’extraits simplifiés ou de mélanges contrôlés. Le but est double :
- d’une part proposer des outils permettant de mieux comprendre les effets synergiques souvent observés lors de l’investigation biologique de substances naturelle
- d’autre part de développer des stratégies rapides et efficientes de caractérisation d’ingrédients actifs naturels en réponse à la pression croissante des contraintes réglementaires (réglementation cosmétique, REACH…).
Ce travail associe le développement d’outils de fractionnement basés sur l’utilisation de l’Extraction de Partage Centrifuge (EPC) à des protocoles d’analyses statistiques multivariées appliqués aux résultats des analyses spectrales des fractions générées.
Les composés (ou substances) naturels issus de la biodiversité végétale ont des intérêts multiples mis à profit dans différents domaines : en alimentation, en dermocosmétologie, en thérapeutique, en phytosanitaire, …. Parmi ces composés, on retrouve dans une grande mesure les métabolites secondaires qui se sont surtout illustrés en thérapeutique. La Pharmacie utilise encore une forte proportion de médicaments d’origine végétale et la recherche trouve chez les plantes des molécules actives nouvelles, ou des matières premières pour l’hémi-synthèse de nouveaux agents thérapeutiques. L’objectif de nos activités de recherche porte sur l’étude des composés naturels de structure complexe isolés à partir de sources végétales.
Le premier volet de cette recherche s’attache au développement et à l’exploitation des techniques d’extraction, de fractionnement et d’analyse spectroscopique (RMN, SM) à des métabolites complexes (alcaloïdes, saponosides, polyphénols, glycolipides, glucosinolates, terpènes). Les espèces végétales étudiées sont des plantes soit d'origine tropicale, sélectionnées pour une activité pharmacologique ou pour leur appartenance à des familles botaniques intéressantes (Sapindaceae, Apocynaceae, Fabaceae, Symplocaceae, Rhamnaceae, Asteraceae, Violaceae, …), soit régionales de grande culture, dans le cadre de valorisations non alimentaires de ces végétaux (Luzerne, Vigne, Betterave, ...).
La détermination de structure de ces métabolites fait appel à la maîtrise et à l'utilisation intensive des techniques de RMN multi-impulsionnelle à 500 MHz et 600 MHz Les différentes techniques de spectrométrie de masse (FAB, ESI-MS, MS-MS, MALDI-MS) sont également utilisées.
En collaboration avec d'autres équipes françaises et étrangères sont également résolus différents problèmes de structure de métabolites variés.
Le second aspect de notre activité concerne l’étude des propriétés biologiques des métabolites secondaires et leur valorisation potentielle. Quelques tests simples d’évaluation d’activité biologique sont menés au laboratoire comme l’activité hémolytique des saponosides, l’activité anti-radicalaire (test au DiPhénylPicrylHydrazyle), l’activité toxique sur Artemia salina et les activités anti-tyrosinase, anti-élastase. Dans le cadre de l’engagement de notre unité dans l’IFR 53 "Interactions Cellules-MicroEnvironnement" et de ses collaborations, nos efforts se portent sur la connaissance des activités au niveau cellulaire (cytotoxicité, antimicrobienne, antiparasitaire) et de la matrice extracellulaire (MMPs, inflammation, cancer). Ainsi sont réalisés les tests suivants : activité cytotoxique ; activation et inhibition d’enzymes ; activité anti-bactérienne.