Les activités de recherche de l’équipe BSMA sont historiquement orientées vers la conception, la synthèse et l’évaluation biologique de molécules d’intérêt thérapeutique. L’équipe BSMA est partenaire de la SFR CAP-Santé, impliquée dans les axes « progression tumorale », « vieillissement et réparation » et « neurosciences », ainsi que de la SFR Condorcet, au travers du volet « valorisation d’agroressources ».
La chaîne de valeurs de l’équipe BSMA (Biomolécules : Synthèses et Mécanismes d’Action) couvre, comme son nom l’indique :
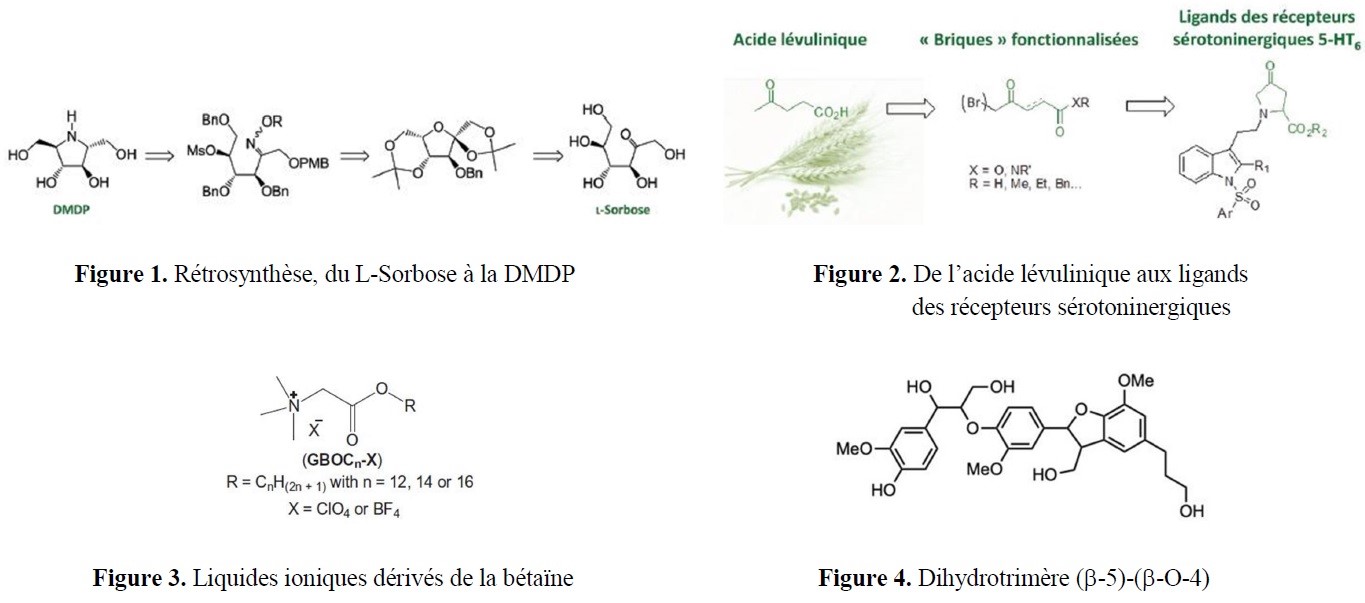
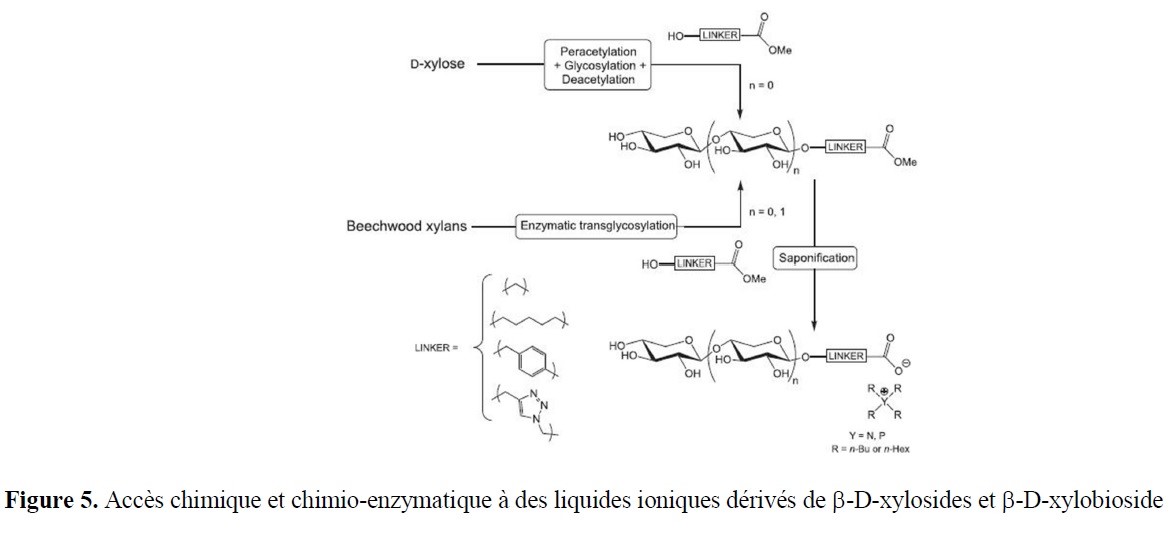
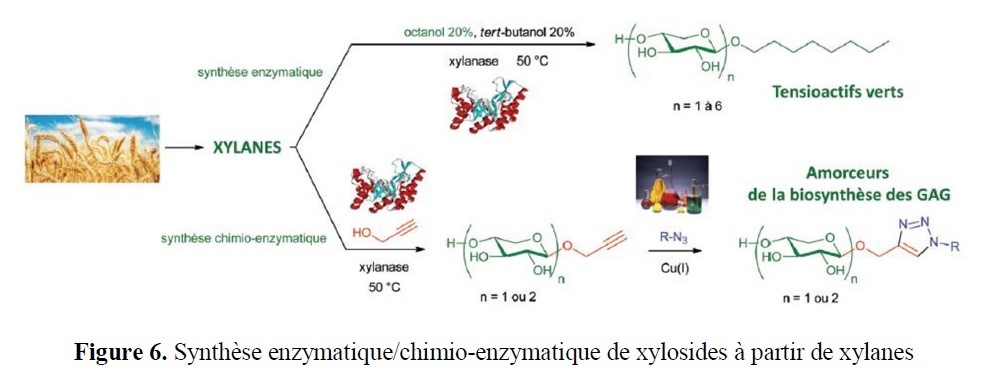
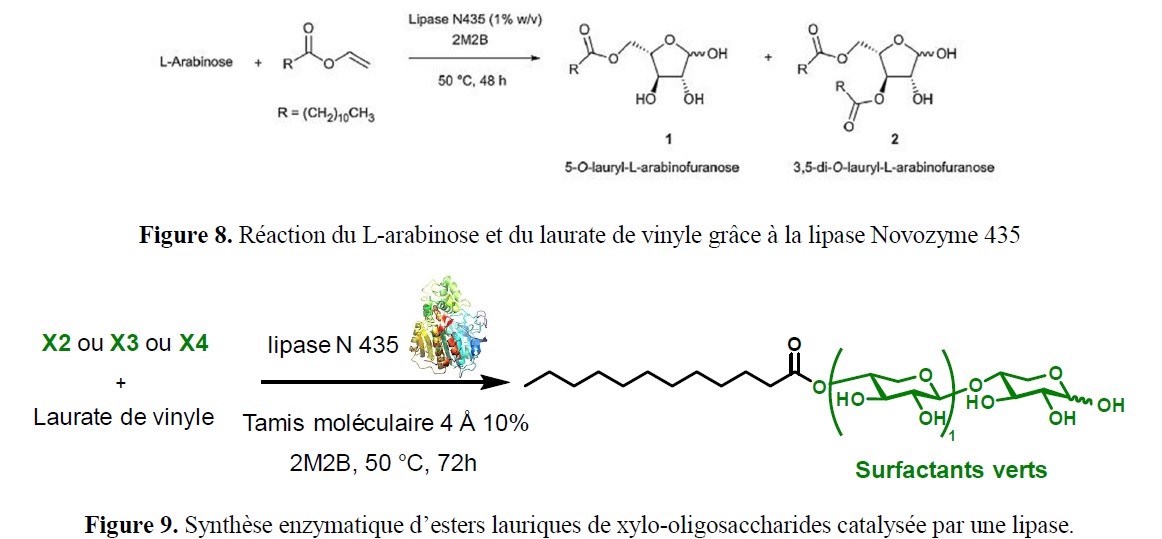
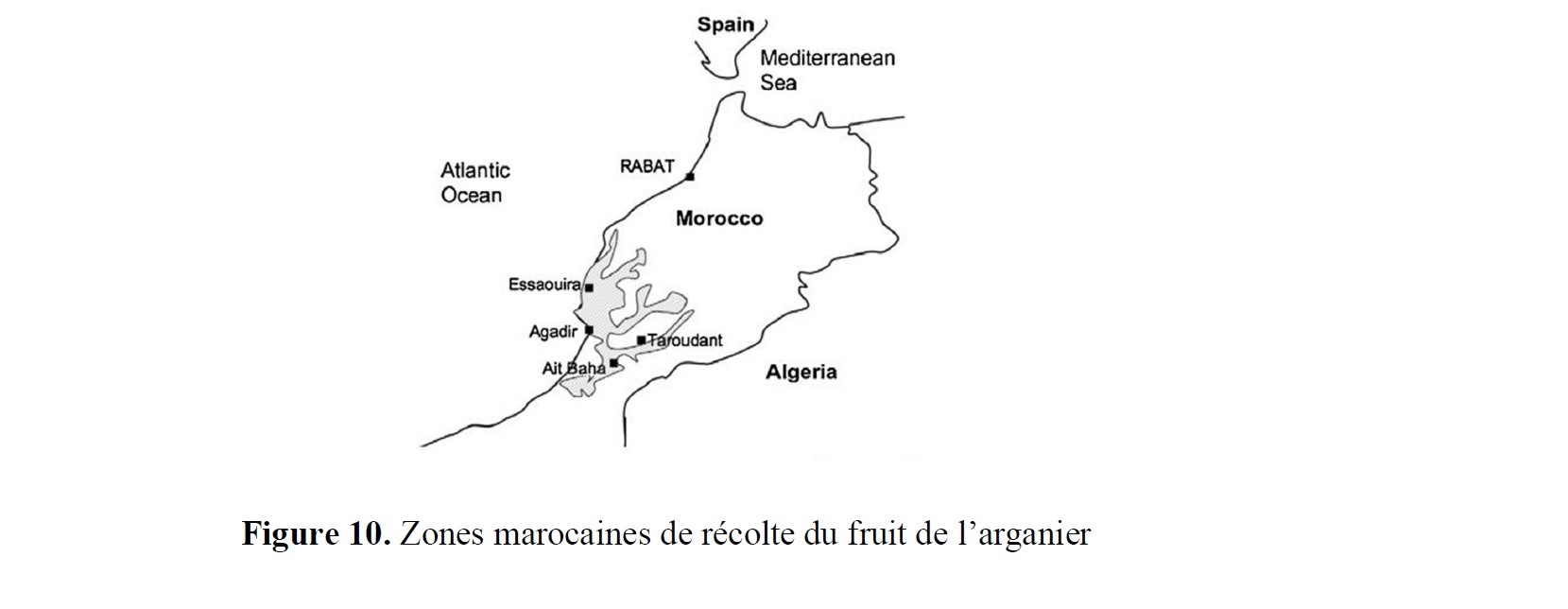
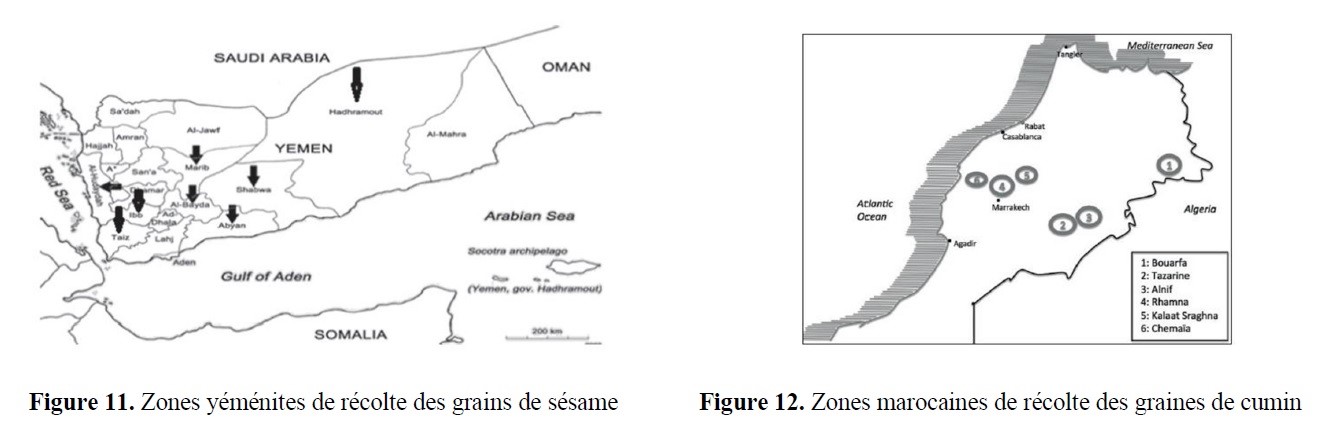
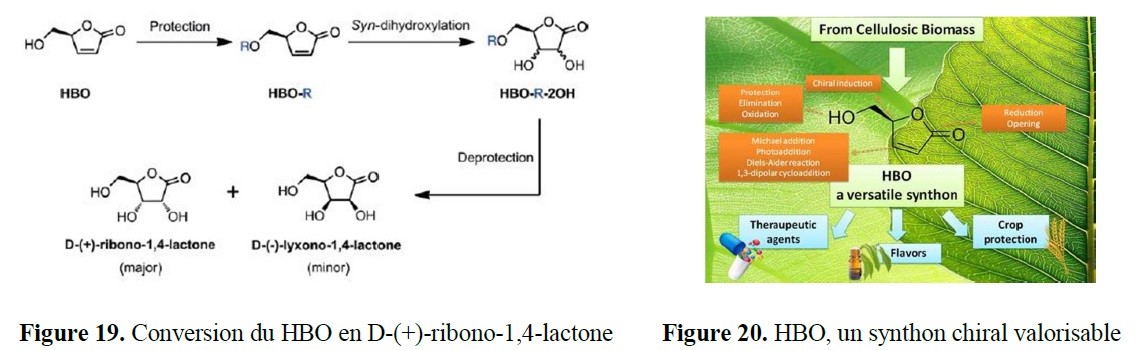
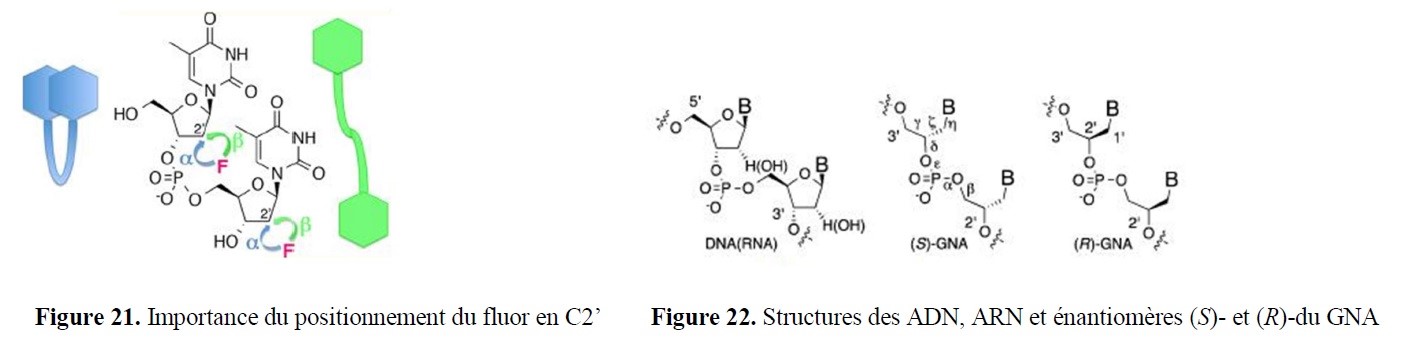
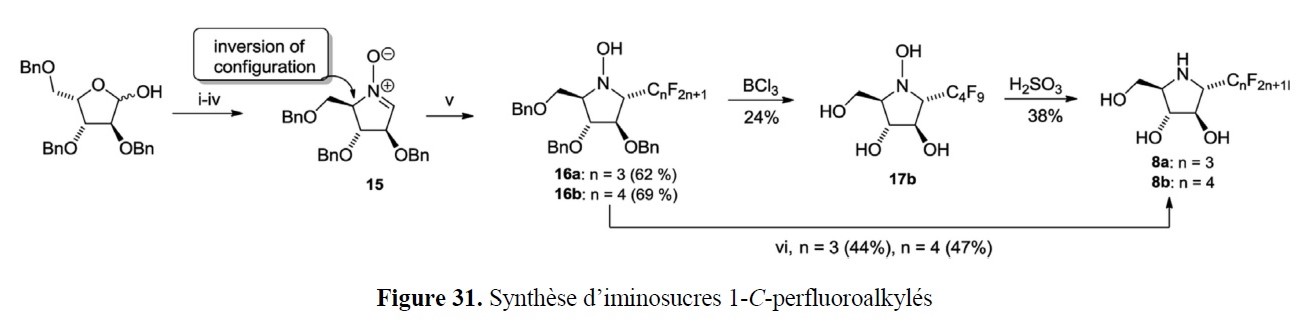
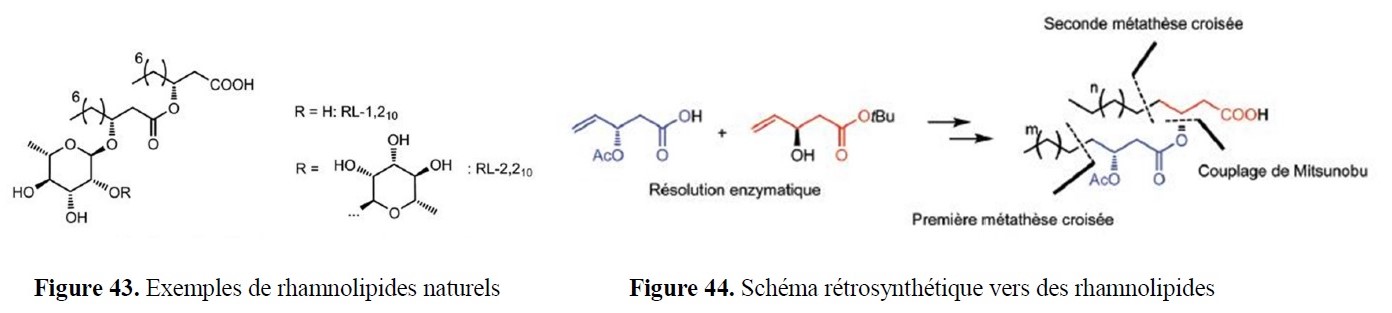
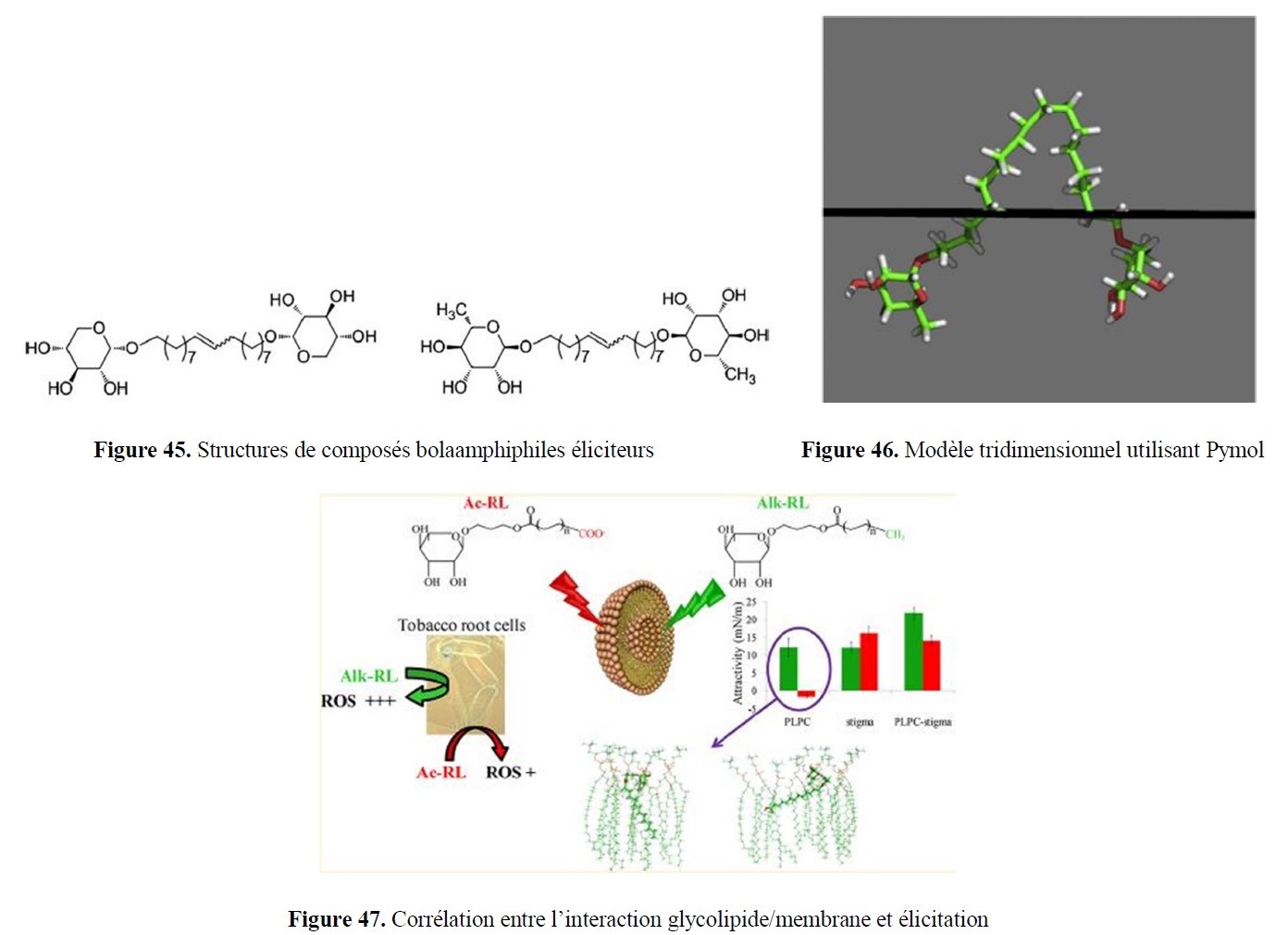
- des implications marquées dans la valorisation d’agroressources d’intérêt régional (utilisation d’hydrates de carbone tels que L-Arabinose, D-Xylose, L-Sorbose et lévoglucosénone, ou encore de l’acide lévulinique,…) ;
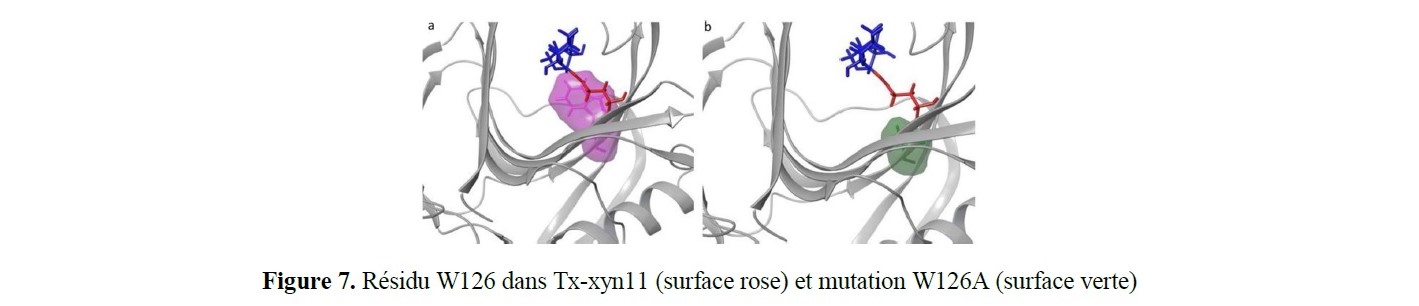
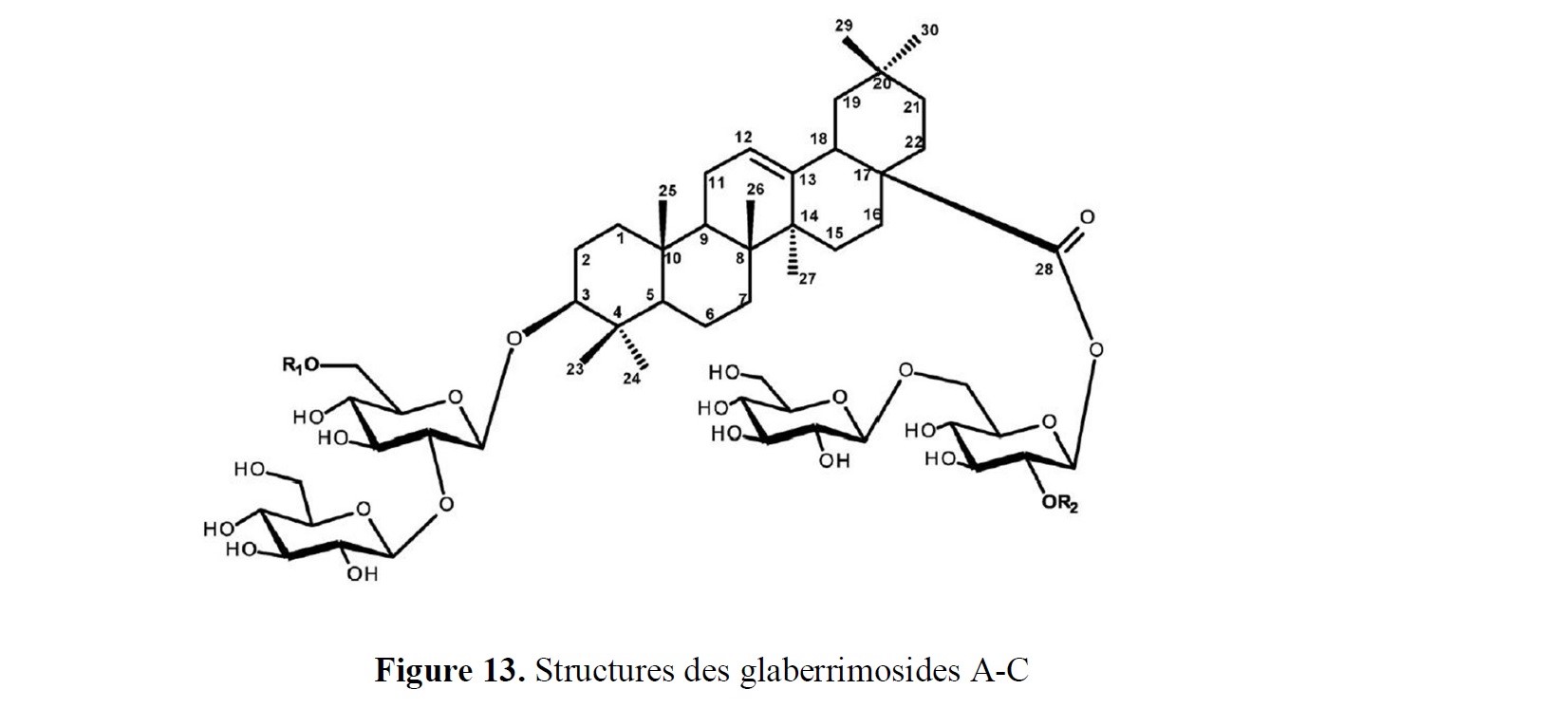
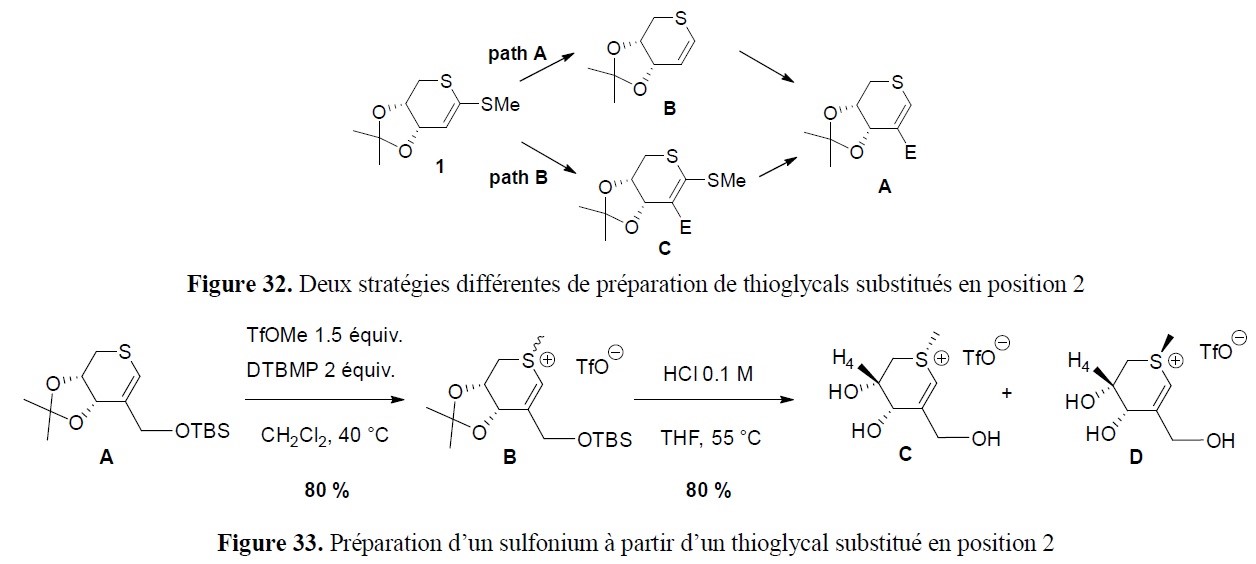
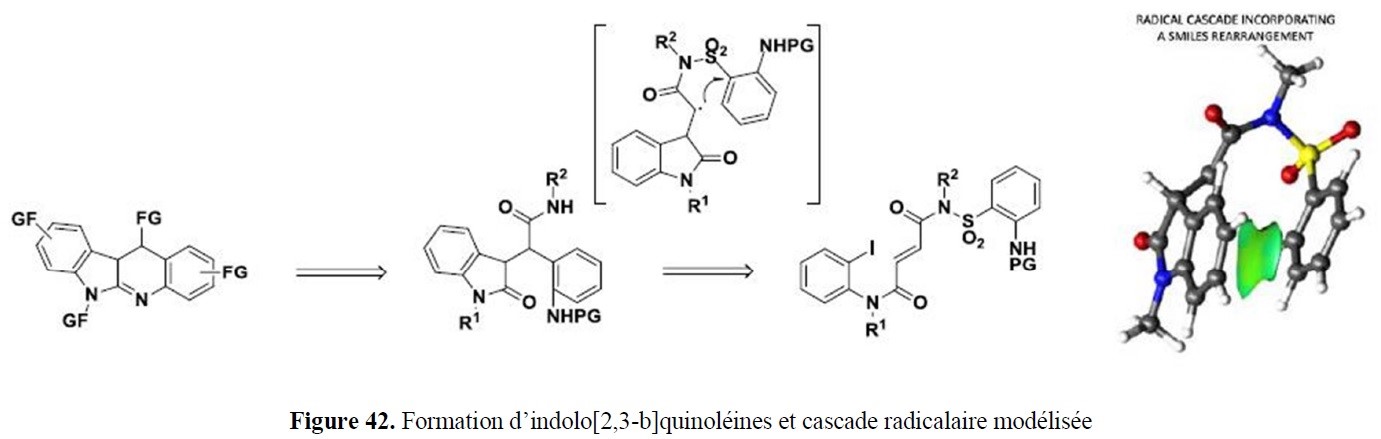
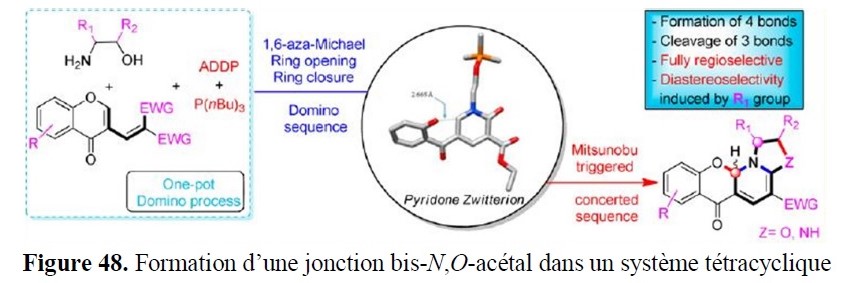
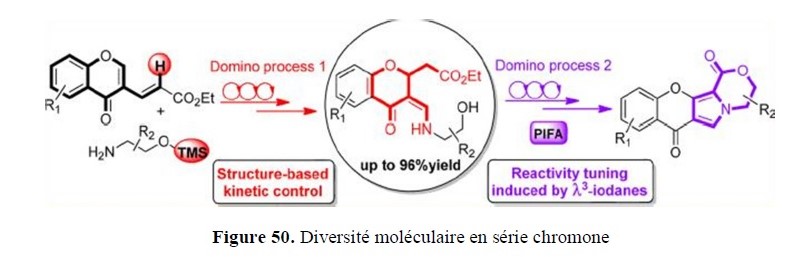
- le développement de nouvelles approches pour accéder à des squelettes rencontrés dans des structures naturelles (par exemple systèmes poly(hétéro)cycliques) ;
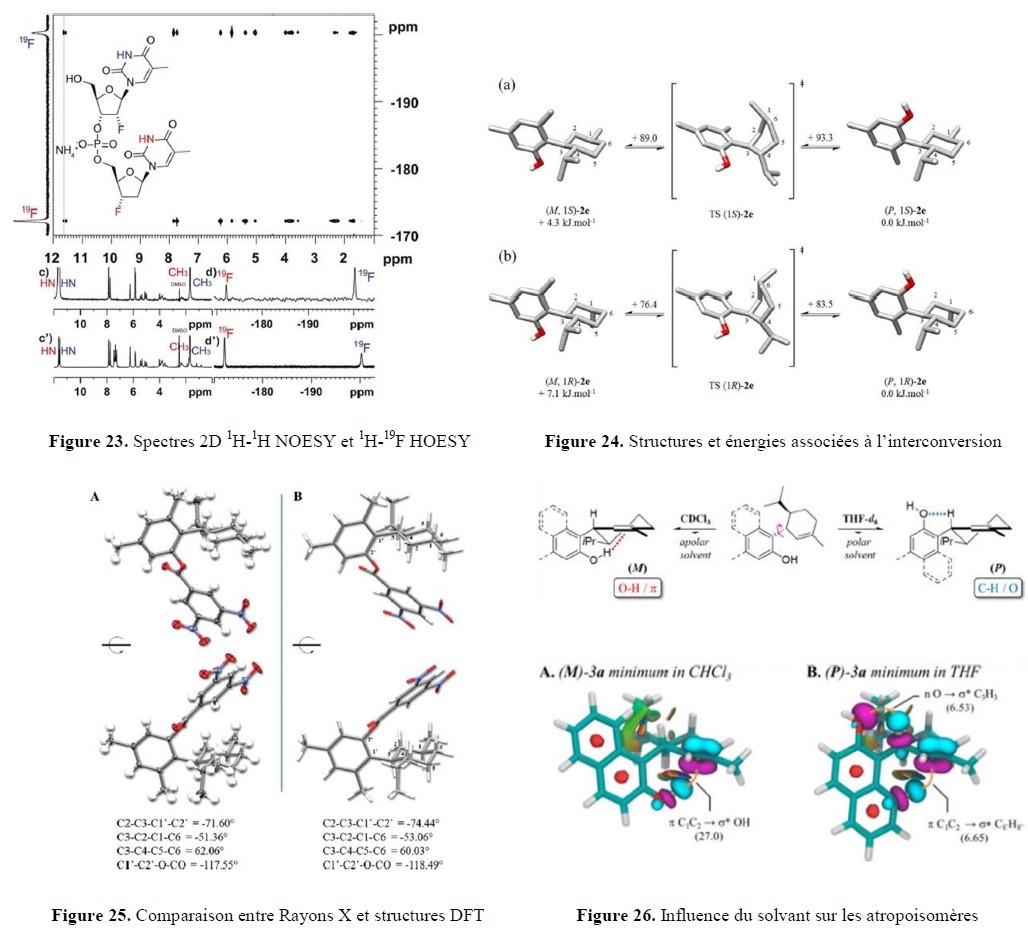
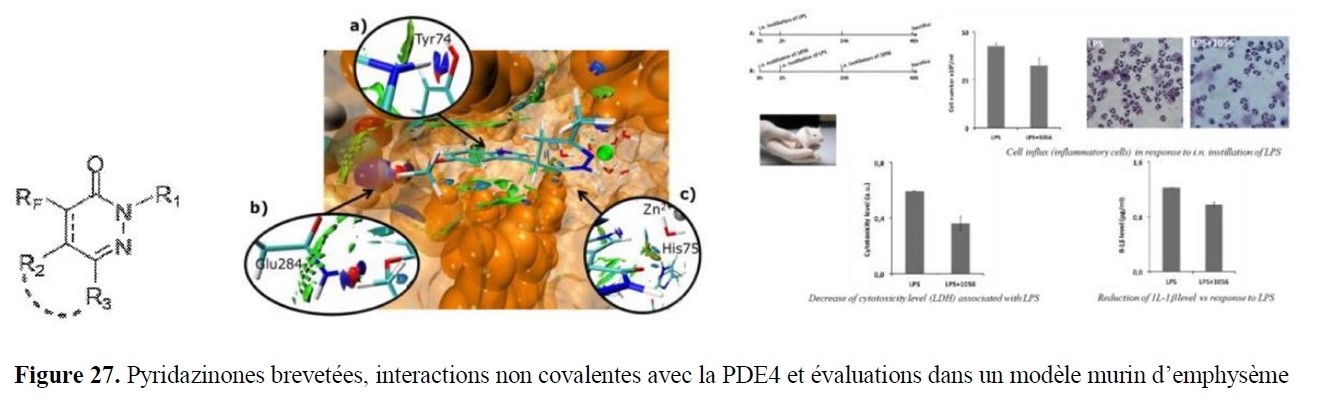
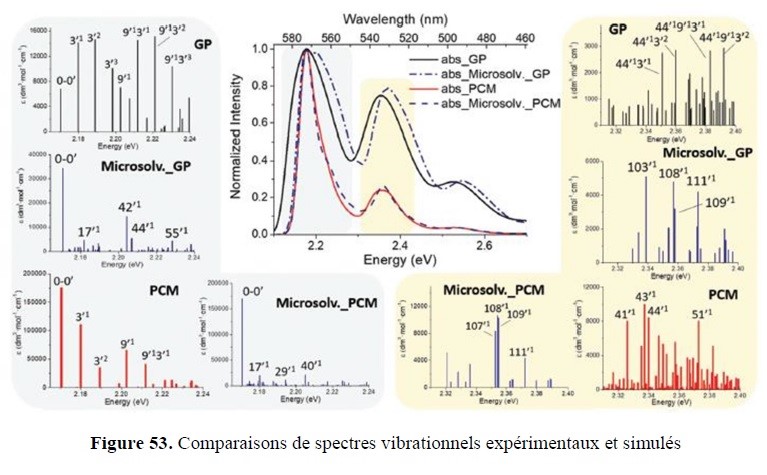
- l’analyse sophistiquée (interaction avec la plateforme PlAneT et l’équipe CSN) afin de mettre en évidence des subtilités structurales, notamment dans l’étude de conformations de motifs nucléotidiques ou d’entités présentant des propriétés d’atropoisomérie ;
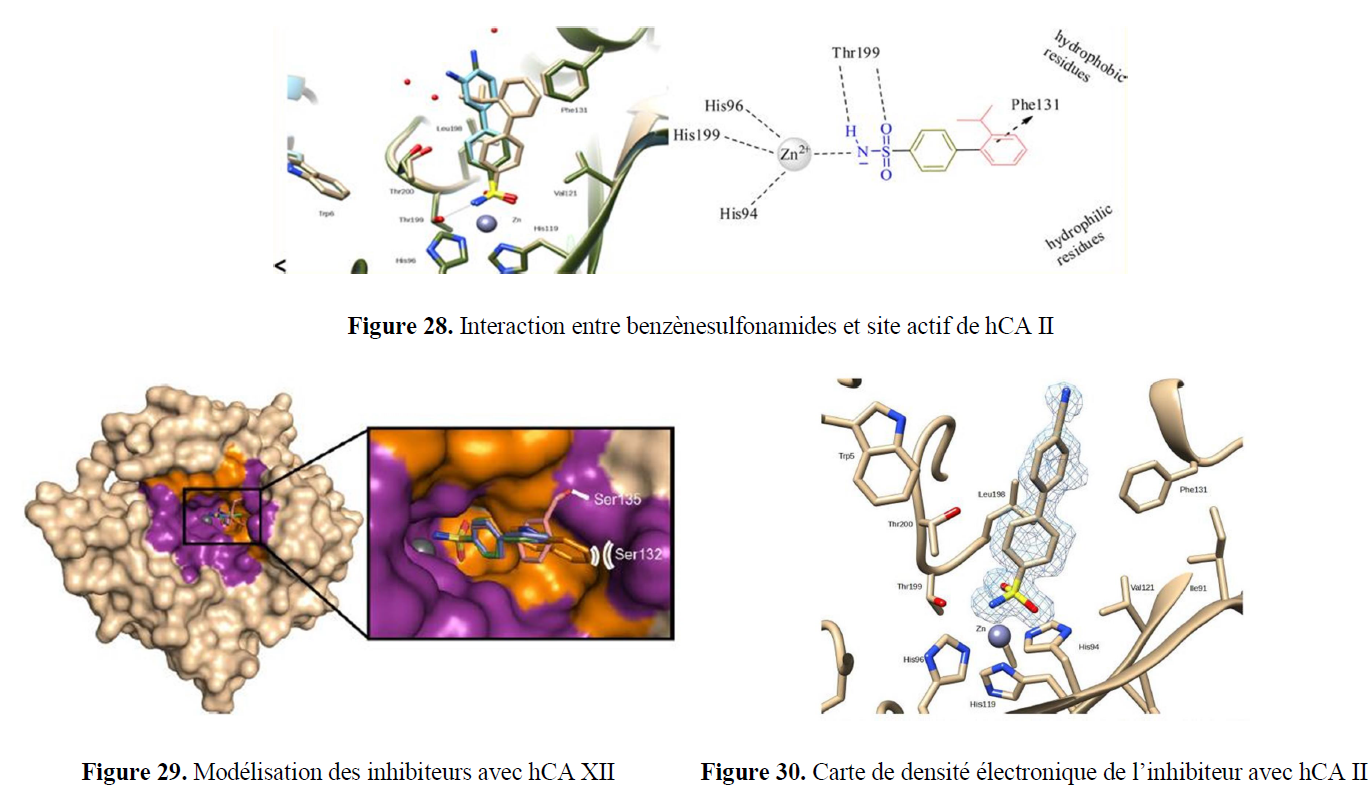
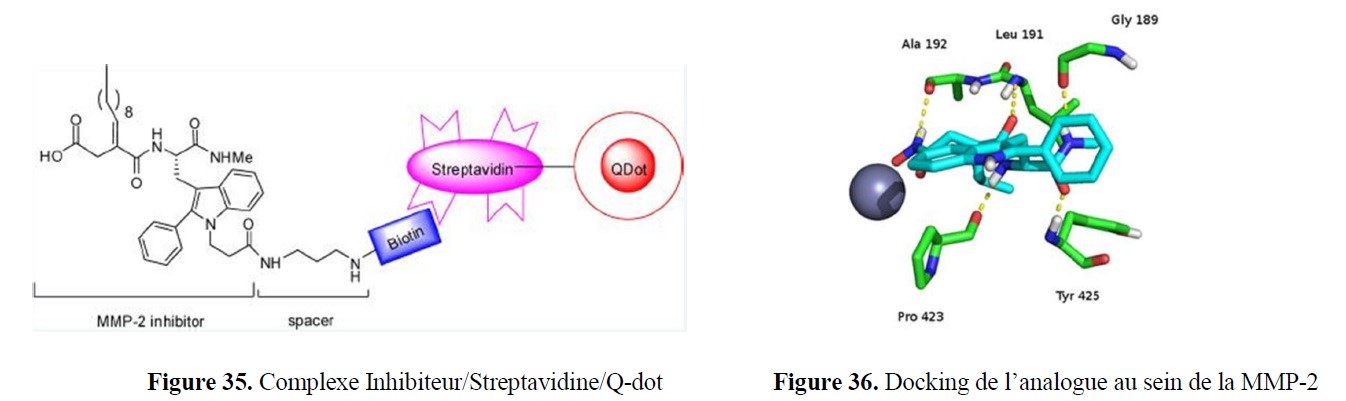
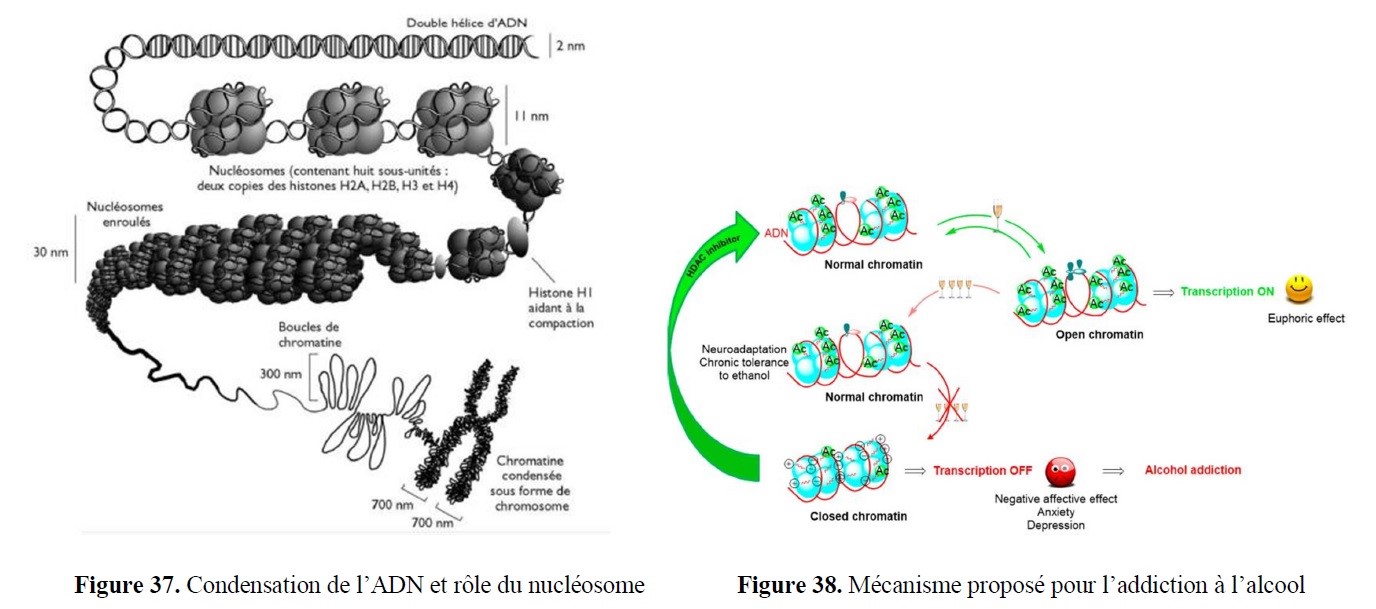
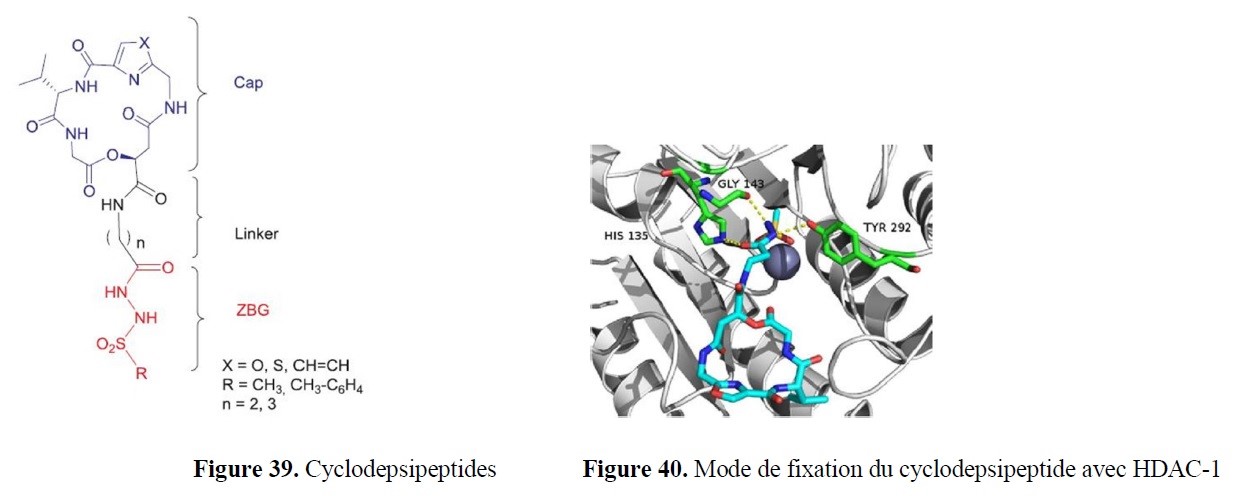
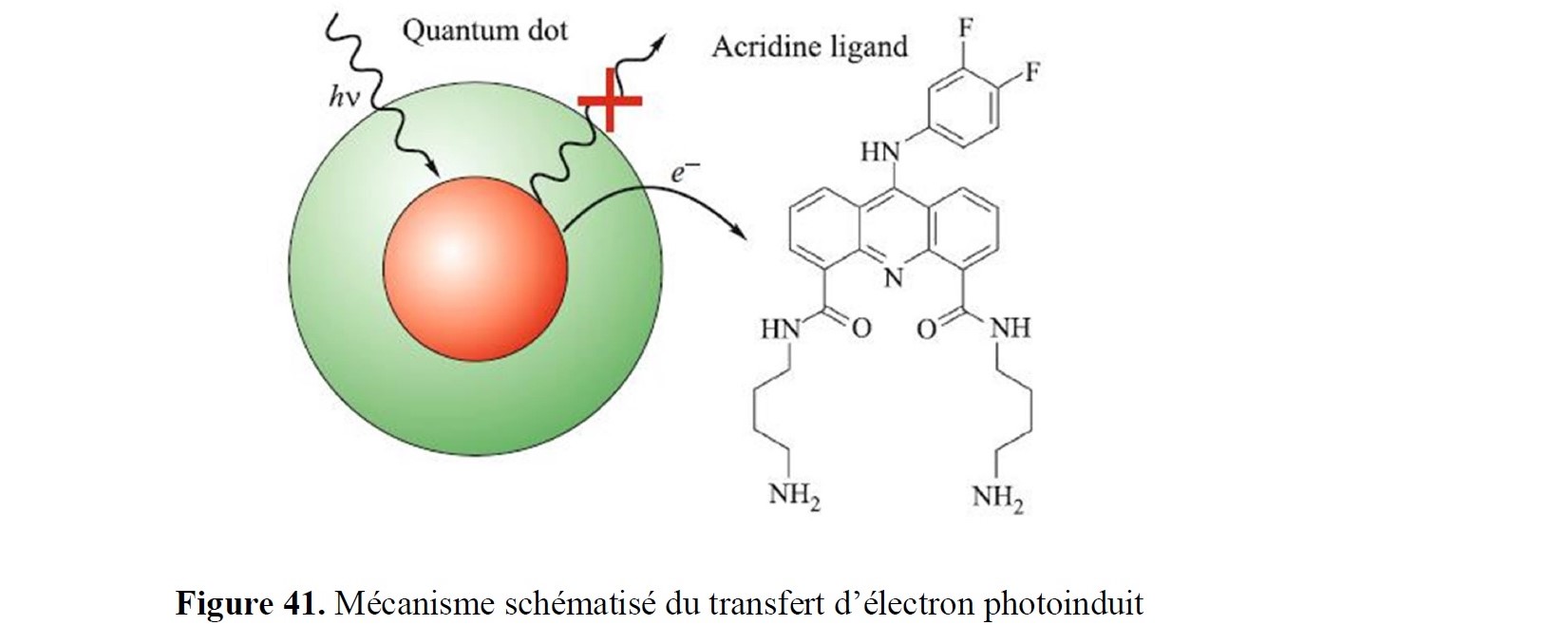
- la synthèse à façon d’inhibiteurs spécifiques ciblant des enzymes d’intérêt, notamment à finalités anti-tumorales, anti-inflammatoires… ;
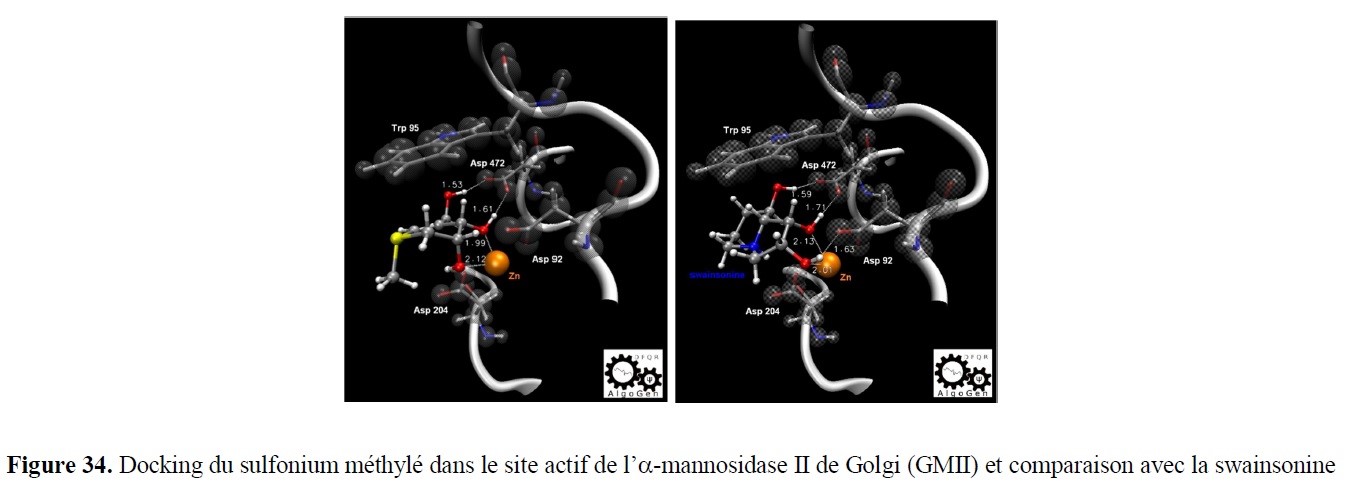
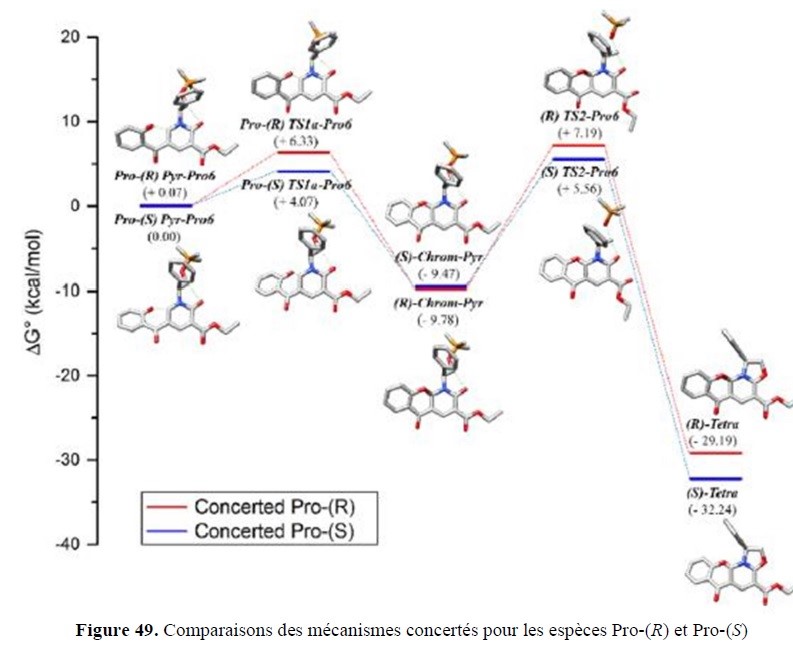
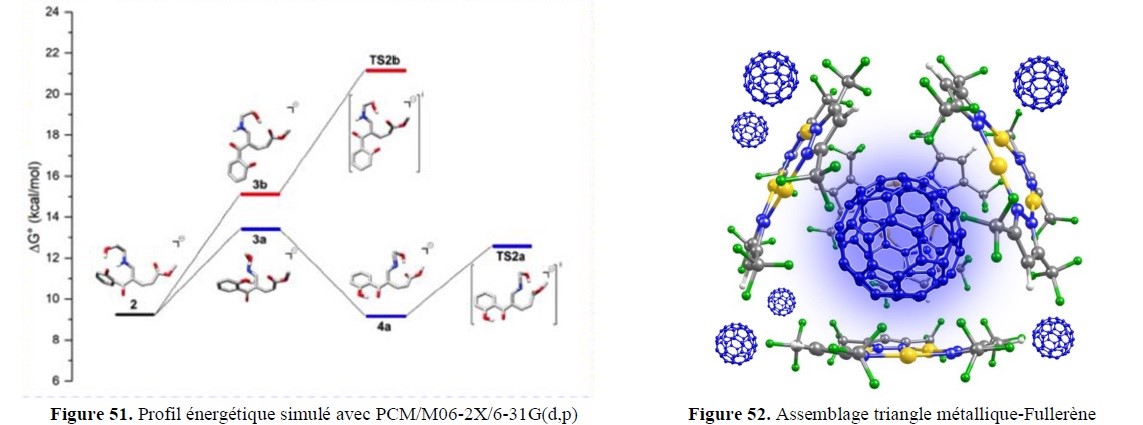
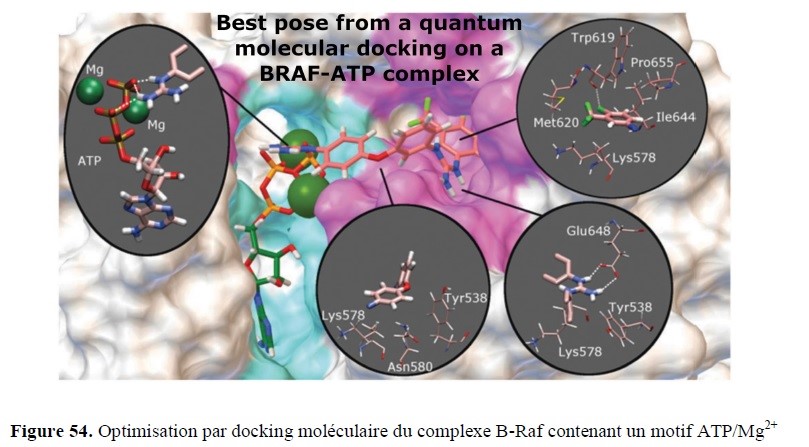
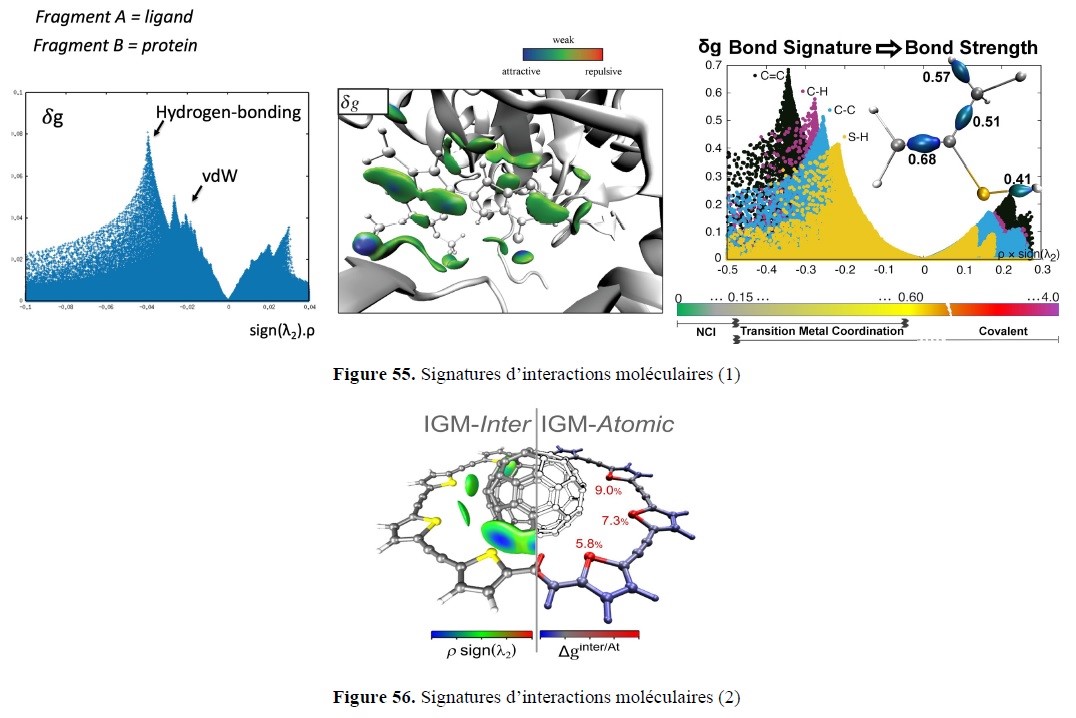
- l’élaboration de nouveaux outils de Modélisation Moléculaire pour identifier, caractériser et quantifier les interactions moléculaires, mais aussi un volet applicatif transversal support des études expérimentales, que ce soit en amont, pour des approches prédictives par dynamique moléculaire ou de docking (drug design), ou en aval, pour la compréhension de mécanismes réactionnels via des calculs quantiques.